XÁC ĐỊNH THÀNH PHẦN LOÀI RICKETTSIA TRÊN CHUỘT VÀ MỘT SỐ NGOẠI KÝ SINH TRÙNG Ở KHU VỰC ĐÓNG QUÂN MỘT SỐ ĐƠN VỊ QUÂN ĐỘI MIỀN BẮC
Viện Y sinh Nhiệt đới, Trung tâm Nhiệt đới Việt - Nga
Số 63 Nguyễn Văn Huyên, Nghĩa Đô, Cầu Giấy, Hà Nội
Số điện thoại: 0982201991; Email: cuongvrtc@gmail.com
Nội dung chính của bài viết
Tóm tắt (Abstract)
DETERMINATION OF THE RICKETTSIA SPECIES IN RATS AND ECTOPARASITES COLLECTED IN SOME MILITARY UNITS IN NORTHERN VIETNAM
Rickettsia, a gram-negative bacterium, and an obligate intracellular bacterium, can potentially cause fatal acute fever if not promptly detected and treated. It's often transmitted to humans by arthropods like ticks, fleas, and lice. Rodents and small mammals can serve as key hosts for various Rickettsia species. Our study aimed to identify Rickettsia species using nested PCR and gene sequencing of ompA, ompB, 17-kDa, and gltA genes based on 29 DNA samples, which tested positive for Rickettsia spp collected from mice, ticks, fleas, and lice at military units in Lang Son, Nghe An, Hai Duong, and Bac Giang, The phylogenetic analysis showed that 9/29 (31%) of Rickettsia samples belonged to Rickettsia felis species, 1/29 (3.5%) of Rickettsia samples exhibited a 99.5% ompB gene sequence similarity to Rickettsia heilongjiangensis species.
Từ khóa (Keywords)
17-kDa, gltA, Nested-PCR, ompA, ompB, Ricketssia
Chi tiết bài viết
1. ĐẶT VẤN ĐỀ
Rickettsia là vi khuẩn Gram âm, ký sinh nội bào bắt buộc. Rickettsia là nguyên nhân chính gây ra bệnh Rickettsioses tryền nhiễm cấp tính có thể gây dịch. Bệnh sốt do Rickettsia là bệnh lây truyền qua vector, thông qua vết cắn của động vật chân đốt khác nhau bao gồm bọ ve, rận, bọ chét, ve [1]. Hiện nay có 27 loài Rickettsia, trong đó 17 loài gây bệnh ở người và các và động vật [2]. Dựa vào đặc điểm lâm sàng và tác nhân gây bệnh các loài Rickettsia được chia ra làm 3 nhóm chính: nhóm sốt nổi mụn (Spotted fever group-SFG), nhóm sốt phát ban (typhus group-TG) và nhóm sốt mò (Scrub typhus group-STG) [3]. Bệnh nhân nhiễm bệnh Rickettsia có thể gây biến chứng như viêm phổi, viêm màng não, suy thận cấp, suy đa tạng và có thể tử vong nếu không được phát hiện và điều trị kịp thời.
Động vật chân đốt y học bao gồm ve, bọ chét, mò là các vector quan trọng truyền bệnh rickettsioses. Bên cạnh đó các động vật gặm nhấm và thú nhỏ được xem là vật chủ nhiều loài Rickettsia [1]. R. typhi, O. tsutsugamushi và các tác nhân Rickettsia thuộc nhóm SFG như R. honei, R. felis đã được xác định là nguyên nhân gây bệnh cho người ở nhiều quốc gia Đông Á và Đông Nam Á [4]. Tại Indonesia, tỷ lệ huyết thanh động vật gặm nhấm dương tính cao 39,1% với sốt nổi mụn được ghi nhận ở một số vùng nông thôn của nước này, R. felis được phát hiện trên bọ chét chuột X. cheopis ở Indonesia [5]. Nghiên cứu trên 2.189 cá thể ve thuộc 19 loài tại Nhật Bản phát hiện 373 mẫu (17%) nhiễm Rickettsia spp.. Xác định được 5 loài Rickettsia: R.asiatica, R. helvetica, R. monacensis, R. tamurae và Candidatus R. tarasevichiae, một số loài thuộc nhóm SFG không xác định [6]. Đã phân lập được 5 loài hoặc kiểu gen trên mẫu ve thu thập tại tỉnh Khammouan (Lào) bao gồm:R. tamurae, R. japonica, Rickettsia sp. ATT, Rickettsia sp. Kagoshima6, và Rickettsia sp. TwKM01 được phân lập trên mẫu ve thu thập tại tỉnh Khammouan (Lào) [7].
Ở Việt Nam, thời gian gần đây đã có một số nghiên cứu về sự lưu hành của Rickettsia trên động vật gặm nhấm, ngoại ký sinh trùng và trên các bệnh nhân. Nghiên cứu tại 27 bệnh viện trong cả nước (2018-2019) các bệnh nhân ghi ngờ sốt do Ricketssia, ghi nhận nhiễm sốt mò, nhiễm sốt phát ban và ca sốt nổi mụn lần lượt là 85,8%, 11,9% và 1,8% [8]. Kết quả nghiên cứu sự lưu hành của Rickettsia SFG và Rickettsia typhi trên động vật gặm nhấm và ngoại ký sinh trùng ở Hà Giang lần lượt 19,3% và 10,8% [9]. Tại một số các đơn vị bộ đội thuộc các tỉnh Điện Biên, Sơn La, Phú Thọ, tỷ lệ dương tính với Rickettsia SFG trên chuột lần lượt là 31,8%, 15,2% và 17,1% [10]. DNA của vi khuẩn R. felis được phát hiện từ các mẫu ve và bọ chét ký sinh trên chó ở Tây Nguyên với tỷ lệ 97,06% [11]. Trong nghiên cứu này chúng tôi tiến hành xác định thành phần các loài Rickettsia trên chuột và ngoại ký sinh trùng thu thập tại 4 đơn vị quân đội đóng quân tại Lạng Sơn, Nghệ An, Hải Dương và Bắc Giang.
2. ĐỐI TƯỢNG, PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Đối tượng nghiên cứu
14 mẫu DNA tổng số từ máu chuột và 15 mẫu DNA tổng số ngoại ký sinh trùng (ve, mò, bọ chét) dương tính với Rickettsia spp. bằng xét nghiệm real-time PCR. Mẫu chuột và ngoại ký sinh trùng thu thập tại 4 đơn vị quân đội đóng quân tại các tỉnh Lạng Sơn, Nghệ An, Hải Dương và Bắc Giang trong thời gian từ tháng 10/2021 đến tháng 5/2023, cụ thể như sau: 07 mẫu DNA tổng số máu chuột nhà (Rattus tanezumi), 04 mẫu DNA tổng số máu chuột đồng nhỏ (R. losea), 03 mẫu DNA tổng số máu chuột cống (R. norvegicus), 09 mẫu DNA tổng số loài ve bò Boophylus microplus, 03 mẫu DNA tổng số loài bọ chét Ctenocephalides orientis, 02 mẫu DNA tổng số loài bọ chét C. felis felis, 01 mẫu DNA tổng số loài mò Laelaps (Laelaps) nuttalli
2.2. Phương pháp nghiên cứu
2.2.1. Phương pháp nested PCR xác định loài Rickettsia
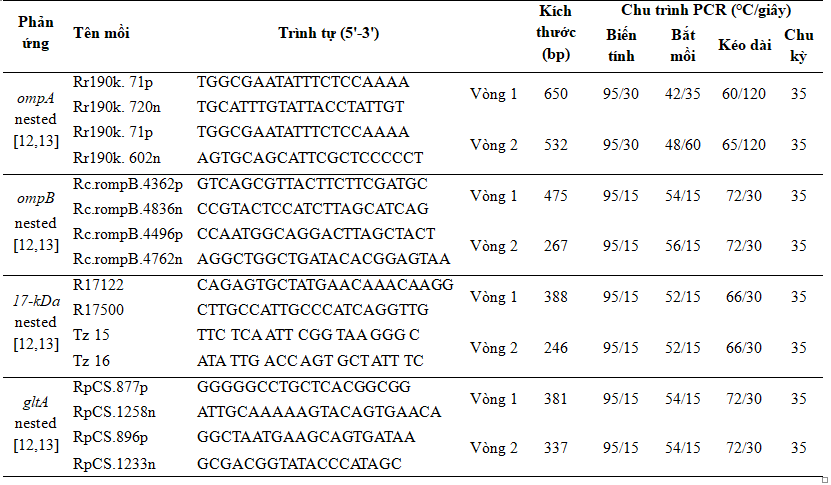
Các mẫu dương tính với Rickettsia bằng kỹ thuật real-time PCR được tiến hành nested PCR để giải trình tự. Mồi sử dụng cho phản ứng nested PCR được dựa trên các gen đặc hiệu của Rickettsialà: 17-kDa, ompA, ompB và gltA [12], [13]. Thông tin về trình tự các mồi sử dụng, chu trình nhiệt, kích thước sản phẩm PCR được trình bày trong Bảng 1.
2.2.2. Tinh sạch sản phẩm nested PCR
Sản phẩm PCR được hiển thị bằng điện di trên gel agarose 1,5%, tiếp theo sản phẩm PCR được tinh sạch bằng bộ kit tinh sạch Jenjet PCR (Thermo, USA). Sau đó, được gửi đi giải trình tự bằng phương pháp Sanger tại công ty Macrogen Inc. (Daejeon, Korea).
2.2.3. Phân tích trình tự và dựng cây phát sinh chủng loại
Các trình tự được sử lí bằng phần mềm Bioedit và so sánh với các trình tự thông qua công cụ Blast-NCBI trên ngân hàng gen. Việc căn chỉnh trình tự, căn chỉnh cột và được thực hiện bằng phần mềm ClustalX2, cây phát sinh chủng loại đươc xây dựng bằng phần mềm MEGA-X (sử dụng phương pháp neighbor-joining) với chỉ số bootstrap 1.000.
2.3. Đạo đức trong nghiên cứu
Nghiên cứu của đề tài đã được Hội đồng Đạo đức trong nghiên cứu y sinh học của Trung tâm Nhiệt đới Việt - Nga thông qua theo giấy chấp thuận số 1533/CN-HĐĐĐ, ngày 24 tháng 5 năm 2021.
Bảng 1. Trình tự mồi sử dụng trong phản ứng nested PCR
3. KẾT QUẢ VÀ BÀN LUẬN
3.1. Kết quả phản ứng Nested-PCR nhân gen ompA, ompB, 17-kDa và gltA
Các mẫu dương tính với real-time PCR sau đó được tiến hành phản ứng Nested-PCR, các cặp mồi sử dụng được thiết kế dựa trên các gen đặc hiệu ompA, ompB, 17-kDa và gltA của Rickettsia. Đây là 4 vùng gen được nhiều nghiên cứu sử dụng trong việc xác định loài ở Rickettsia do nó cho phép xác định về khoảng cách tiến hóa giữa các loài Rickettsia có độ tin cậy cao. Gen ompA, ompB là hai gen mã hóa cho protein màng ngoài (Outer membrane protein) được sử dụng để phát hiện Rickettsia nhóm SFG. Gen 17-kDa (17 kDa lipoprotein precursor antigen gene) và gltA (citrate synthase protein) là hai protein được sử dụng trong phát hiện Rickettsia TG Kết quả phản ứng nhân 04 gen đặc hiệu của Rickettsia spp. được trình bày ở (Bảng 2).
Bảng 2. Kết quả Rickettsia trên mẫu chuột, ve, bọ chét, mò
STT | Mã số/tên loài vector, vật chủ | Địa điểm thu mẫu | Giá trị Ct real time PCR | Kết quả Nested-PCR | |||
|---|---|---|---|---|---|---|---|
ompA | ompB | 17-kDa | gltA | ||||
1 | M02/R. tanezumi | Lạng Sơn | 28.76 | - | + | - | + |
2 | M47/ R. tanezumi | Lạng Sơn | 37,34 | - | - | - | - |
3 | M57/R. tanezumi | Hải Dương | 32,20 | - | + | - | + |
4 | M110/R. losea | Hải Dương | 34,18 | - | - | - | - |
5 | M106/R. losea | Hải Dương | 38,68 | - | - | - | - |
6 | M140/R. losea | Nghệ An | 31,50 | - | + | - | - |
7 | M189/R. tanezumi | Lạng Sơn | 34,18 | - | - | - | - |
8 | M202/R. tanezumi | Lạng Sơn | 38,40 | - | - | - | - |
9 | M239/R. tanezumi | Lạng Sơn | 33,98 | - | + | - | - |
10 | M316/R. norvergicus | Hải Dương | 37,46 | - | - | - | - |
11 | M326/R. norvergicus | Nghệ An | 38,60 | - | - | - | - |
12 | M452/R. norvergicus | Hải Dương | 38,45 | - | - | - | - |
13 | M544/R. losea | Nghệ An | 38,41 | - | - | - | - |
14 | M653/R. tanezumi | Bắc Giang | 39,11 | - | - | - | - |
15 | BC04/C. feliss | Nghệ An | 38,41 | - | - | - | - |
16 | BC05/C. feliss | Nghệ An | 37,00 | - | - | - | - |
17 | VE28/B. microplus | Nghệ An | 38,05 | - | - | - | - |
18 | VE31/B. microplus | Nghệ An | 38,07 | - | + | - | - |
19 | VE50/B. microplus | Bắc Giang | 22,64 | + | + | + | + |
20 | VE52/B. microplus | Bắc Giang | 35,31 | - | + | - | - |
21 | BC57/C. orientis | Bắc Giang | 38,28 | - | + | - | - |
22 | BC58/C. orientis | Bắc Giang | 38,41 | - | - | + | - |
23 | VE66/B. microplus | Bắc Giang | 37,00 | - | - | - | - |
24 | VE89/B. microplus | Bắc Giang | 38,4 | - | - | - | - |
25 | VE109/B. microplus | Hải Dương | 23,40 | + | + | + | + |
26 | VE122/B. microplus | Hải Dương | 37,87 | - | + | - | - |
27 | VE125/B.microplus | Hải Dương | 38,53 | - | - | - | - |
28 | BC152/C. orientis | Hải Dương | 39,40 | - | - | - | - |
29 | MO155/L. (L.) nuttalli | Hải Dương | 38,55 | - | - | - | - |
Tổng số mẫu (+) |
| 2 | 10 | 3 | 4 | ||
Kết quả Bảng 2 cho thấy gen ompB, gltA, 17-kDa và ompA được khuếch đại lần lượt trong 10, 04, 03 và 02 mẫu chuột và mẫu ngoại ký sinh trùng. Phần lớn các mẫu DNA khuếch đại được gen đặc có giá trị Ct dưới chu kỳ 35. Điều này có thể giải thích các mẫu DNA tổng số phát hiện Rickettsia spp với giá trị Ct trên chu kỳ 35 có số lượng vi khuẩn thấp, dưới ngưỡng khuếch đại của kỹ thuật Nested-PCR. Trong số 10 mẫu DNA khuếch đại được gen ompB có 04 mẫu chuột R. tanezumi, 05 mẫu ve B. microplus và 01 mẫu bọ chét C. orientis. Gen gltA được tìm thấy trong 04 mẫu, trong đó có 02 mẫu chuột R. tanezumi và 02 mẫu ve B. microplus. Gen 17-kDa phát hiện trong 03 mẫu, gồm 02 mẫu ve và 01 mẫu bọ chét C. orientis. Gen ompA phát hiện trên 02 mẫu ve.
3.2. Phân tích trình tự và xây dựng cây phát sinh chủng loại
Sản phẩm Nested-PCR được tinh sạch bằng Kit tinh sạch Jenjet PCR theo hướng dẫn của nhà sản xuất và giải trình tự tại công ty Macrogen (Hàn Quốc). Kết quả thu được 15 trình tự bao gồm 09 trình tự gen ompB và 03 trình tự gen 17-kDa, 02 trình tự gen gltA và 01 trình tự gen ompA. Cây phát sinh chủng loại được xây dựng dựa trên những trình tự thu thập được ở 4 gen này kết hợp với các trình tự gần gũi thu nhận trên GenBank.
Kết quả phân tích với cây phát sinh chủng loại được xây dựng dựa trên một phần trình tự gen ompB khi so sánh với các trình tự tham chiếu trên GenBank (Hình 1A) cho thấy 08/09 trình tự gen ompB có độ tương đồng 100% với các trình Rickettsia felis đã công bố, 01 trình tự gen ompB trong mẫu chuột M57 thu thập có mối quan hệ gần gũi với trình tự gen ompB loài Rickettsia heilongjiangensis có mã số trên ganbank là AY280712 với độ tương đồng 99,5%. Với gen 17-kDa, đã khuếch đại và giải trình tự 03 đoạn gen từ mẫu ve VE50, VE109 và mẫu bọ chét BC58. Kết quả phân tích cây phát sinh chủng loại (Hình 1B) cho thấy cả 3 mẫu này đều thuộc loài Rickettsia felis với độ tương đồng 100%. Với gen ompA, gltA chỉ khuếch đại được ở mẫu ve VE50 và mẫu VE109.
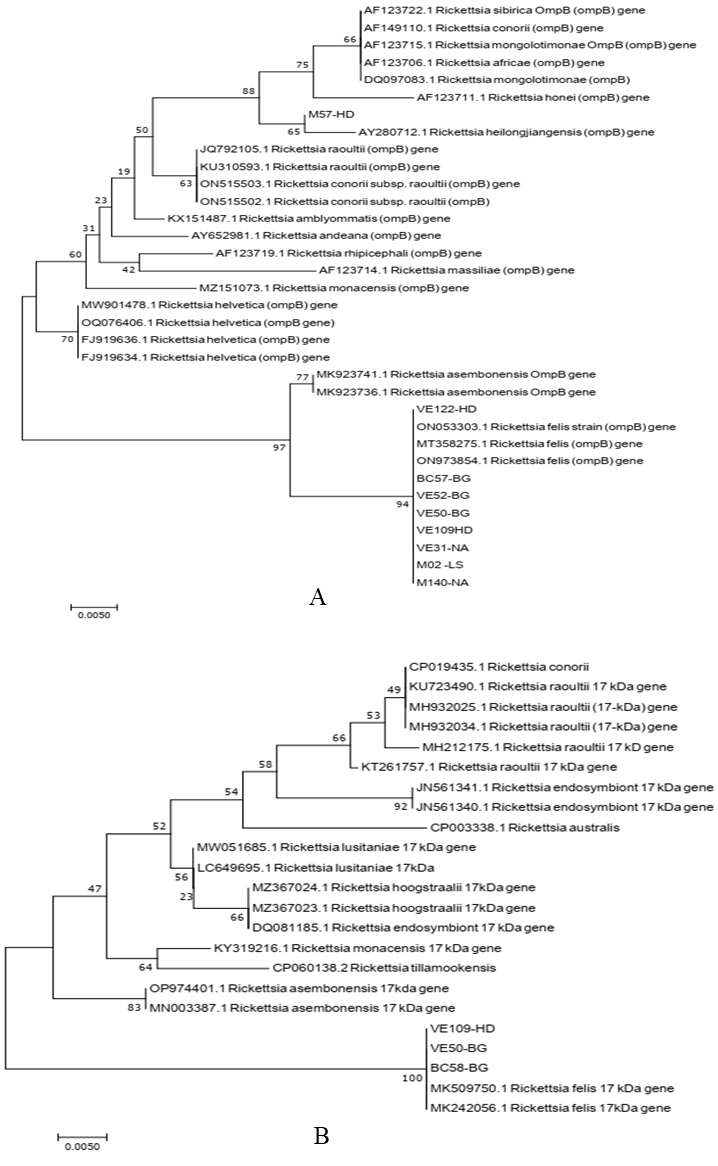
Hình 1. Cây phát sinh chủng loại vi khuẩn Rickettsia dựa trên một phần trình tự
của ompB (A) và một phần trình tự gen 17-kDa (B) bằng phương pháp
neighbor-joining với chỉ số bootstrap 1000
Kết quả xây dựng cây phát sinh chủng loại dựa trên 2 gen ompA, gltA cho thấy, DNA tổng số ở cả 2 mẫu ve VE50 và VE109 đều xuất hiện sự có mặt của vi khuẩn Rickettsia felis do có độ tương đồng 100% và thuộc cùng nhánh phân loại với các trình tự Rickettsia felis khác đã công bố trên GenBank (kết quả cây phát sinh chủng loại 02 gen ompA, gltA không thể hiện trong bài báo).
R. felis là một mầm bệnh rickettsia do côn trùng mới nổi và là tác nhân gây bệnh sốt phát ban do bọ chét. Lần đầu tiên được mô tả là mầm bệnh từ người Hoa Kỳ vào năm 1991, R. felis hiện được xác định trên toàn thế giới và được coi là nguyên nhân gây sốt phổ biến ở Châu Phi [14, 15]. Tại Việt Nam gần đây có một số công bố về sự lưu hành của R. felis cũng như R. heilongjiangensis tại Hà Giang, khu vực Tây Nguyên. Kết quả này là tương đồng với các nghiên cứu khác, khi mà các nghiên cứu trước đây đã khẳng định rằng R. felis là loài phổ biến trên chó, mèo [16] và mới đây nhất trong nghiên cứu của Nguyễn Quốc Hiếu năm 2023, đã xác định 97,06% vi khuẩn Rickettsia spp. được tìm thấy trong các mẫu ve và bọ chét ký sinh trên chó mèo ở Tây Nguyên là loài R. felis [11].
Tỷ lệ lưu hành Rickettsia tại các đơn vị quân đội thường có xu hướng thấp hơn khi so sánh với tỷ lệ này ngoài cộng đồng dân cư. Lý do là trong các đơn vi quân đội công tác phòng chống dịch được thực hiện thường xuyên và chặt chẽ hơn. Trong nghiên cứ này mặc dù chưa có ca bệnh được ghi nhận nhưng đang có rất nhiều mầm bệnh Rickettsia felis và vector truyền bệnh như ve bò B. microplus, bọ chét mèo C. felis felis, C. orientis trong 4 đơn vị thuộc Quân khu 1, Quân khu 3 và Quân khu 4. Việc chưa phát hiện ca bệnh có thể do chưa có kỹ thuật phát hiện, chưa được quan tâm chẩn đoán hoặc chưa có thông tin đầy đủ. Đây là những sinh vật sống gần người, quá trình sinh hoạt và huấn luyện của bộ đội có thể tiếp xúc với các vector truyền bệnh và có thể nhiễm bệnh. Do vậy, việc dự phòng và điều trị bệnh do Rickettsia cho bộ đội cần được quan tâm tại những đơn vị này.
4. KẾT LUẬN
Nghiên cứu đã xác định 9/29 (31%) mẫu vi khuẩn Rickettsia trong các mẫu DNA tổng số chuột và ngoại ký sinh trùng là thuộc loài Rickettsia felis. 01/29 (3,5%) mẫu có mức độ tương đồng 99,5% với loài Rickettsia heilongjiangensis. Kết quả nghiên cứu đã chỉ ra rằng Rickettsia felis là loài lưu hành chủ yếu tại 4 đơn vị quân đội đóng quân ở Lạng Sơn, Nghệ An, Hải Dương và Bắc Giang.
Lời cảm ơn: Nghiên cứu được hoàn thành nhờ sự tài trợ kinh phí của Bộ Quốc phòng thông qua đề tài “Nghiên cứu sự lưu hành vector truyền bệnh, vi sinh vật gây bệnh ở một số đơn vị quân đội hoạt động khu vực phía Bắc Việt Nam và hoàn thiện test nhanh phát hiện nhiễm Orientia tsutsugamushi”.
Tài liệu tham khảo
2. Fang R., Blanton L. S., Walker D. H., Rickettsiae as emerging infectious agents, Clin Lab Med., 2017, 37(2):383-400.
3. Siriphan Gonwong, Carl J. Mason, Nationwide Seroprevalence of Scrub Typhus, Typhus and Spotted Fever in Young Thai Men, Am. J. Trop. Med. Hyg., 2022 May, 106(5):1363-1369.
4. Ngamprasertchai T., Hanboonkunupakarn B., Piyaphanee W., Rickettsiosis in Southeast Asia: Summary for international travellers during the COVID-19 Pandemic, Trop. Med. Infect. Dis., 2022 Jan 27, 7(2):18. doi: 10.3390/ tropicalmed7020018.
5. Widjaja S., Williams M., Winoto I., Farzeli A., Stoops C. A., Barbara K. A., Richards A. L., Blair P. J., Geographical assessment of rickettsioses in Indonesia, Vector Borne Zoonotic Dis, 2016 Jan, 16(1):20-25.
6. Thu M. J., et al., Diversity of spotted fever group rickettsiae and their association with host ticks in Japan, Sci. Rep., 2019 Feb 6, 9(1):1500. doi: 10.1038/s41598-018-37836-5.
7. Taylor A. J., et al., Large-Scale Survey for Tickborne Bacteria, Khammouan Province, Laos, Emerg. Infect. Dis., 2016 Sep, 22(9):1635-9. doi: 10.3201/eid2209.151969.
8. Nguyen Vu Trung, et al., Systematic surveillance of rickettsial diseases in 27 hospitals from 26 provinces throughout Vietnam, Tropical Medicine and Infectious Disease, 2022, 7:88.
9. Lê Thị Lan Anh, et al., Phát hiện DNA của vi khuẩn Rickettsia và Orientia tsutsugamushi trên động vật gặm nhấm và ngoại ký sinh trùng ở Hà Giang, Tạp chí Công nghệ Sinh học, 2020, 18(3):543-552.
10. Trịnh Văn Toàn, et al., Xác định thành phần loài, sự hiện diện của các tác nhân gây bệnh Rickettsia SFG và Orientia tsutsugamushi trên chuột tại ba tỉnh trên địa bàn quân khu 2, Tạp chí Khoa học và Công nghệ nhiệt đới, 2022, 26:101-109.
11. Nguyen H. Q., D. J. C. I. Ng-Nguyen, Rickettsia felis and species of fleas parasitizing on household dogs in the Central Highlands of Vietnam, Microbiology, and I. Diseases, 2023, 92:101926.
12. Noh Y, Lee YS, Kim HC, et al., Molecular detection of Rickettsia species in ticks collected from the southwestern provinces of the Republic of Korea, Parasit Vectors, 2017, 10(1):20.
13. Portillo A., et al., Genetic characterisation of ompA, ompB and gltA genes from Candidatus Rickettsia rioja, Clin. Microbiol. Infect, 2009, 15(Suppl 2):307-308.
15. Chriefer M. E., Sacci J. B., Jr. Dumler J. S., Bullen M. G., Azad A. F., Identification of a novel rickettsial infection in a patient diagnosed with murine typhus, J. Clin. Microbiol., 1994, 32(4):949-54.
15. Brown L. D., Macaluso K. R., Rickettsia felis, an Emerging Flea-Borne Rickettsiosis, Curr. Trop. Med. Rep., 2016, 3:27-39. doi: 10.1007/s40475-016-0070.
16. N. N. Dinh, H. Sze-Fui, H. M. Thi, N. V. Thi, R. Rees, Domestic dogs are mammalian reservoirs for the emerging zoonosis flea-borne spotted fever, caused by Rickettsia felis, Sci. Rep., 2020, 10:4151.