ĐẶC ĐIỂM GEN MÃ HÓA KHÁNG NGUYÊN NadA, NHBA CÁC CHỦNG Neisseria meningitidis NHÓM HUYẾT THANH B PHÂN LẬP Ở VIỆT NAM GIAI ĐOẠN 2014 - 2024
Viện Y sinh nhiệt đới, Trung tâm Nhiệt đới Việt-Nga
Số 63 Nguyễn Văn Huyên, Nghĩa Đô, Cầu Giấy, Hà Nội
Số điện thoại: 0982201991; Email: cuongvrtc@gmail.com
Nội dung chính của bài viết
Tóm tắt (Abstract)
Bệnh nhiễm trùng do não mô cầu là một bệnh truyền nhiễm cấp tính do N. meningitidis gây ra, bệnh tiến triển nhanh, có tỷ lệ tử vong cao nếu không điều trị kịp thời. Sử dụng vắc xin được xem là một trong những biện pháp hiệu quả nhất để phòng chống dịch bệnh do NMC. Do sự đa dạng cao các kháng nguyên trong thành phần vắc xin dự phòng NMC nhóm huyết thanh B, việc đánh giá mức độ bao phủ kháng nguyên trong vắc xin 4CMenB với kháng nguyên các chủng NMC nhóm huyết thanh B hết sức cần thiết. Nghiên cứu đặc điểm gen mã hóa cho kháng nguyên NadA, NHBA của chủng N. meningitidis nhóm huyết thanh B thu thập, phân lập giai đoạn 2014 - 2024 cho thấy tỉ lệ mang gen nadA là 27,9%. 100% thuộc variant 4/5, trong đó peptit 139,87 chiếm tỉ lệ lần lượt 66,7% và 33,3%. Trong số 83 trình tự gen nhba đã xác định 17 allele đã biết và 2 allele mới mã hóa cho 18 peptit. Allele 41 và peptit 16 chiếm tỉ lệ cao nhất lần lượt 61,4% và 55,4%. Có sự khác biệt về variant và peptit kháng nguyên NadA cũng như allele và peptit NHBA trên các chủng N. meningitidis nhóm huyết thanh B phân lập ở Việt Nam giai đoạn 2014 - 2024 so với kháng nguyên NadA và NHBA trong vắc xin 4CMenB
Abstract
Neisseria meningitidis is the bacterium responsible for meningococcal infections. The disease often occurs and progresses rapidly, with high fatality rate without treatment. Vaccination is considered one of the most effective measures to control epidemics caused by N. menningitidis. Because of high diversity of antigen components in serogroup B meningococcal vaccines, it is necessary to evaluate the coverage of serogroup B meningococcal vaccine 4CMenB. Research on the characteristics of nadA, nhba genes coding for the NadA and NHBA antigens of N. meningitidis serogroup B strains collected and isolated in the period 2014 - 2024 showed that the rate of carrying the nadA gene was 27.9%. All NadA variants belonged to subtype 4/5, with peptide 139 and 87 accounting for 66.7% and 33.3%, respectively. Among the 83 nhba gene sequences analyzed, 17 alleles were identified, two novel sequences were determined, and 18 NHBA peptides were found. Allele 41 and peptide 16 accounted for the highest proportions at 61.4% and 55.4%, respectively. There were notable differences in the variant distribution and NadA peptide as well as the NHBA peptide of N. meningitidis serogroup B strains isolated during the period 2014 - 2024 compared to previously reported NadA variant and NHBA peptide in the 4CMenB vaccine.
Từ khóa (Keywords)
4CMenB, NadA, NHBA, serogroup B, Meningococcal meningitis, nhóm huyết thanh B, Viêm màng não mô cầu
Chi tiết bài viết
- Điểm nổi bật:
Xác định tỉ lệ mang gen nadA trong 161 chủng N. meningitidis nhóm huyết thanh B (2014 – 2024) là 27,9%. 100% thuộc variant 4/5, trong đó peptit 139, 87 chiếm tỉ lệ lần lượt 66,7% và 33,3%.
Trong số 83 trình tự gen nhba đã xác định 17 allele đã biết và 2 allele mới mã hóa cho 18 peptit NHBA. Allele 41 và peptit 16 chiếm tỉ lệ cao nhất lần lượt 61,4% và 55,4%.
1. ĐẶT VẤN ĐỀ
Bệnh nhiễm trùng do não mô cầu (NMC) là một bệnh truyền nhiễm cấp tính, gây dịch được lây truyền qua đường hô hấp do nhiễm loại song cầu Neisseria meningitidis. Vi khuẩn xâm nhập vào cơ thể người qua đường mũi họng, từ đó lan tỏa vào máu gây nhiễm trùng máu hoặc qua đường máu đến màng não gây viêm màng não mủ hoặc gây viêm màng não mủ kèm theo nhiễm trùng huyết. Bệnh tiến triển nhanh và thường để lại di chứng nặng nề, tỷ lệ tử vong từ 8 đến 15% [1]. NMC có nhiều nhóm huyết thanh khác nhau, đại đa số ca bệnh nhiễm não mô cầu là do các nhóm huyết thanh A, B, C, Y và W135 gây nên. Sự phân bố các nhóm huyết thanh gây ra bệnh thay đổi theo thời gian và giữa các vùng địa lý khác nhau [2]. Sử dụng vắc xin được xem là một trong những biện pháp hiệu quả nhất để phòng chống dịch bệnh do NMC. Vắc xin polysaccharide cộng hợp protein đã được sử dụng và có hiệu quả cao để dự phòng NMC nhóm A, C, W135 và Y. Đối với NMC nhóm huyết thanh B, vắc xin polysaccharide không thể phát triển được do kháng nguyên polysaccharide giống với polysaccharide trong các mô thần kinh của người nên không có tính sinh miễn dịch [3].
Sử dụng vắc xin NMC nhóm B dựa trên kháng nguyên protein màng ngoài PorA đã được nghiên cứu, phát triển từ những năm 1980. Vắc xin hiệu quả phòng bệnh do các chủng bản địa, giúp làm giảm tỷ lệ mắc bệnh trong các vụ dịch tại Na Uy, Cu Ba, New Zealand và Pháp [4]. Tuy nhiên, hiện nay chưa có dữ liệu về hiệu quả bảo vệ của vắc xin đối với các chủng NMC nhóm B thuộc các serosubtype khác nhau. Ngoài ra vắc xin này có tính sinh miễn dịch thấp ở trẻ dưới 4 tuổi và thời gian bảo vệ ngắn. Để dự phòng nhiều chủng NMC nhóm B gây dịch, vắc xin nhiều thành phần đã được nghiên cứu và sản xuất. Năm 2015 Cơ quan Quản lý Thực phẩm và Dược phẩm Mỹ cho phép sử dụng 2 loại vắc xin có tên thương mại là 4CMenB và Trumenba. Vắc xin 4CMenB chứa hỗn hợp 4 loại protein: protein liên kết yếu tố H - fHbp, protein kết dính A - NadA, kháng nguyên liên kết heparin - NHBA, protein màng ngoài PorA serosubtype P1.4. Vắc xin được chỉ định cho trẻ trên 2 tuổi và người trưởng thành dưới 20 tuổi. 4CMenB được cấp phép sử dụng ở nhiều quốc gia khác như: Mỹ, Anh, Australia, Canada, Chile, Colombia …[5].
NadA là protein kết dính, giúp NMC xâm nhiễm vào tế bào. Gen nadA có mặt trong khoảng 50% các chủng phân lập trên các ca bệnh, các chủng phân lập trên người khỏe mạnh thường ít mang gen này. Protein NadA có 6 variant, được ký hiệu NadA-1 đến NadA-6, được chia làm 4 nhóm dựa trên mức độ tương đồng của các variant: NadA-1, NadA2/3, NadA4/5 và NadA-6 [6]. Kháng thể kháng protein NadA1, NadA-2, NadA-3 phản ứng chéo với nhau. Gen nhba có kích thước khoảng 1500 bp, mã hóa kháng nguyên NHBA có trọng lượng phân tử khoảng 50 kDa, được xếp thành nhiều sub-variant khác nhau [7]. Thành phần NadA và NHBA trong vắc xin 4CMenB là NadA-3 sub/variant 8 và NHBA peptit 2 [5]. Nghiên cứu này trình bày đặc điểm gen mã hóa kháng nguyên NadA, NHBA của các chủng N. meningitidis nhóm huyết thanh B phân lập giai đoạn 2014 - 2024.
2. ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Chủng vi sinh vật
161 chủng N. meningitidis nhóm huyết thanh B thu thập, phân lập giai đoạn 2014 - 2024 do Viện Y sinh nhiệt đới, Trung tâm Nhiệt đới Việt - Nga cung cấp, trong đó 29 chủng phân lập từ ca bệnh, 132 chủng phân lập từ người khỏe mạnh (tuổi 18 - 20 tuổi). Theo khu vực địa lý, có 56 chủng phân lập tại các tỉnh phía Nam (TP. Hồ Chí Minh, Nha Trang), 105 chủng phân lập ở khu vực miền Bắc (Thái Nguyên, Hà Giang, Lạng Sơn, Bắc Giang, Hải Phòng, Hà Nội, Nghệ An, Hà Tĩnh).
2.2. Hóa chất
- Kít tách chiết ADN, (BS88505, Bio Basic, Canada), PCR master mix (2X) (NEB, Anh), kit tinh sạch sản phẩm PCR (EZ-10 Spin Column Kit, Biobasic, Canada), kít giải trình tự gen BigDye™ Terminator v3.1 Cycle Sequencing Kit (ABI, Mỹ).
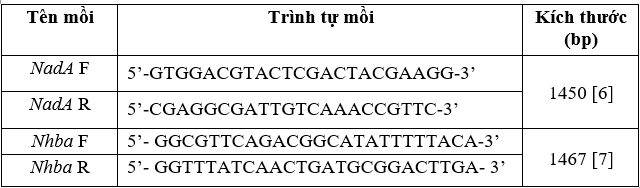
- Trình tự mồi nhân gen nadA, nhba (Bảng 1)
Bảng 1. Trình tự cặp mồi nhân gen nadA, nhba
2.3. Phương pháp nghiên cứu
2.3.1. Khuếch đại và giải trình tự gen nadA, nhba
ADN vi khuẩn được tách chiết bằng bộ kit tách chiết ADN (Bio Basic, Canada) theo quy trình của nhà sản xuất.
Thành phần phản ứng PCR khuếch đại gen các nadA và nhba được thực hiện với tổng thể tích (50µL), gồm: 25 µL hỗn hợp phản ứng nồng độ 2x (2x PCR master mix); 1,25 µL/phản ứng mồi (10 pmol); 19,5 µLH2O; 3 µLDNA khuôn. Chu trình nhiệt phản ứng khuyếch đại gen nadA: 95oC/2 min, 35 chu kỳ (95oC/20s; 56oC/30s; 68oC/60s; 68oC/ 4 min; 4oC - ∞. Chu trình nhiệt cho phản ứng khuyếch đại gen nhba: 95oC/2 min, 35 chu kỳ (95oC/10s; 550C/5s; 72oC/60s), 72oC/ 4 min; 4oC - ∞.
Trình tự nucleotide của các đoạn gen được xác định theo phương pháp của Sanger trên máy xác định trình tự ADN tự động ABI prism 3100 Sequencer (Applied Biosystems) với bộ kít xác định trình tự BigDye® Terminater v3.1 Cycle Sequencing Kit của hãng Applied Biosystems.
2.3.2. Xác định variant gen nadA, allele nhba và peptit NHBA
Kết quả giải trình tự gen 2 chiều được lắp ráp thành đoạn gen hoàn chỉnh bằng phần mềm ChromasPro (https://technelysium.com.au/wp/chromaspro/), Sequencher 4.5.6; BioEdit. Sự tương đồng về trình tự của các đoạn gen nadA, nhba với các trình tự của các gen công bố trên ngân hàng dữ liệu NCBI được đánh giá bằng công cụ BlastN. Variant, peptit NadA và allele nhba, peptit NHBA được xác định dựa trên dữ liệu N. meningitidis trên website: https://pubmlst.org/organisms/neisseria-spp.
3. KẾT QUẢ
3.1. Đặc điểm gen nadA
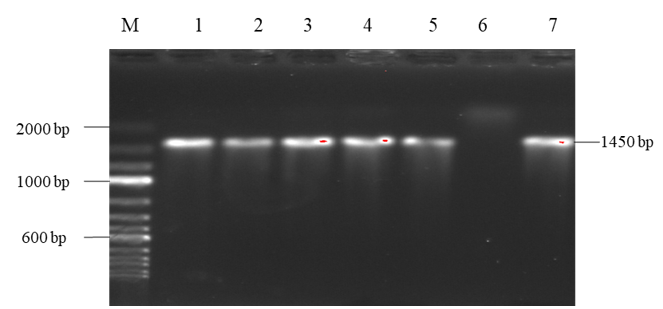
Hình 1. Điện di sản phẩm PCR khuếch đại gen nadA
Đường chạy M: Marker (100bp); đường chạy 1-5, 7: mẫu dương tính với gen nadA, đường chạy 6: mẫu âm tính với gen nadA.
Trong số 161 chủng N. meningitidis nhóm huyết thanh B phân lập giai đoạn 2014 - 2024, bằng kỹ thuật PCR đã xác định được 45 chủng mang gen nadA, tương ứng với tỉ lệ 27,9% (Hình 1). Gen nadA xuất hiện với tỉ lệ cao các chủng phân lập trên ca bệnh (15/29, 51,7%), các chủng phân lập trên người mang mầm bệnh không triệu chứng tỉ lệ mang gen nadA thấp hơn (30/132, 22,7%).
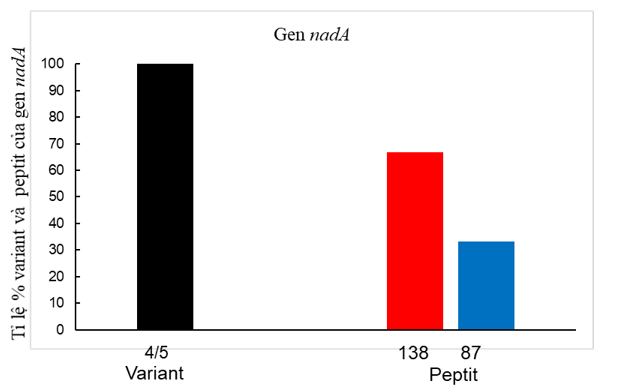
Hình 2. Variant và kiểu peptit của NadA
Kết quả xác định các variant của NadA dựa trên trình tự axit amin suy diễn cho thấy 100% thuộc variant 4/5. Đối với peptit NadA chỉ ghi nhận peptit 138 và 87. Peptit 139 chiếm tỉ lệ 30/45 (66,7%), peptit 87 là 15/45 (33,3%) (Hình 2).
3.2. Đặc điểm gen nhba
Trong nghiên cứu này chúng tôi sử dụng 83/161 chủng N. meningitidis nhóm huyết thanh B được lựa chọn để trình tự gen nhba. Kết quả phân tích allele đã xác định được 17 loại, trong đó allele 41 chiếm đa số (51/83, 61,4%), tiếp theo allele 311 và 916 chiếm tỉ lệ tương đương nhau 7,2% (5/83), các allele còn lại chiếm tỉ lệ thấp, nhỏ hơn 5%, 2/83 trình tự chưa xác định được allele từ cơ sở dữ liệu gen nhba trên website: https://pubmlst.org/organisms/neisseria-spp. Phân tích trình tự peptit suy diễn xác định được 18 loại, trong đó peptit 16 chiếm tỉ lệ cao nhất 55,4% (46/83), tiếp theo peptit 1654 và 511 chiếm tỉ lệ lần lượt 12% (10/83) và 7,2% (6/83) (Hình 3).
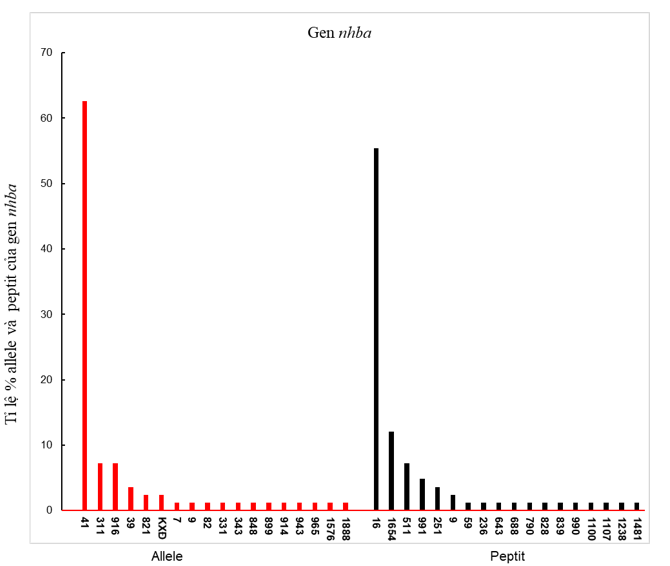
Hình 3. Phân bố các allele nhba và peptit NHBA
4. BÀN LUẬN
Hiện tại chưa có công bố dữ liệu về variant cũng như kiểu peptit NadA của N. meningitidis phân lập ở Việt Nam. Kết quả nghiên cứu sự có mặt gen nadA trên các chủng N. meningitidis tương đồng với kết quả công bố trên thế giới, các chủng phân lập từ ca bệnh có tỉ lệ mang gen cao hơn so với chủng phân lập trên người khỏe mạnh, tỉ lệ mang gen nadA khác nhau giữa các nhóm huyết thanh. Nghiên cứu quy mô đa quốc gia của nhóm tác giả Comanducci và cộng sự cho thấy gen nadA có mặt với tỉ lệ xấp xỉ 50% trên các chủng N. meningitidis phân lập từ ca bệnh, trong khi đó tỉ lệ mang gen nadA các chủng phân lập từ người khỏe mạnh chỉ 16,2% [6]. Trong số 1052 chủng N. meningitidis phân lập tại Anh, Xứ Wales, Pháp, Đức, Italy và Na Uy chỉ 22,3% mang gen nadA, giải trình tự gen 97 trong số 535 ở Anh và Xứ Wales xác định 31 chủng mang variant NadA-1 hoặc NadA-2/3, 58 chủng mang variant NadA-4/5, 8 chủng không xác định [8]. Nghiên cứu của Green và cộng sự cho thấy 30% các chủng N. meningitidis phân lập trên ca bệnh ở Anh giai đoạn 2010 - 2016 mang gen nadA, 65,9% không mang gen nadA và 3,7% không được chú thích. Trong số các chủng mang gen nadA 64,2% thuộc variant NadA-2/3, 15,4% variant NadA-1 và 20,5% thuộc về variant NadA-4/5, các peptit thuộc variant 1 [9]. Tỷ lệ lưu hành gen nadA trên 662 chủng N. meningitidis nhóm huyết thanh B phân lập ở Ba Lan thời gian từ 2010 đến 2016 là 34%, variant NadA-1, peptit 1 chiếm 71,6%. NadA-2/3, peptit 8 chỉ có mặt ở 1 chủng [10].
Tại Mỹ, trong số 401 chủng N. meningitidis phân lập giai đoạn 2009 - 2014 chỉ có 22% các chủng mang gen nadA, trong đó 50% thuộc nhóm huyết thanh W135, 40% nhóm huyết thanh B, 24,8% nhóm huyết thanh C. Variant NadA-1 lưu hành chủ yếu ở nhóm huyết thanh B, trong khi variant chủ yếu ở các nhóm huyết thanh khác ngoài nhóm B là NadA-2/3 [11]. Gen nadA được phát hiện với tỉ lệ 37,5% trên tổng số 144 chủng N. meningitidis phân lập tại 25 tỉnh của Trung Quốc giai đoạn 1963 đến 2011, trong đó tỉ lệ mang các chủng phân lập trên ca bệnh là 21,5% [12]. Nghiên cứu tương tự trên 485 chủng NMC nhóm huyết thanh B thu thập tại 29 tỉnh ở Trung Quốc (1968 - 2016) phát hiện 89% mang gen nadA, kết quả giải trình tự toàn bộ hệ gen của 10 chủng đại diện xác định 6 variant 2/3 và 4 variant 4/5 [13]. NadA cùng với NHBA, fHbp và PorA bốn kháng nguyên của vắc xin 4CMenB để dự phòng não mô cầu nhóm huyết thanh B. Variant NadA-2/3, peptit 8 trong vắc xin 4CMenB không xuất hiện ở bất kỳ chủng N. meningitidis nào trong nghiên cứu này. Một số nghiên cứu cho thấy sự tương đồng và khả năng miễn dịch chéo giữa variant 2/3 và 4/5 của NadA ở mức thấp [6]. Điều này cho thấy cần tiếp tục mở rộng nghiên cứu để đánh giá đầy đủ hơn các variant NadA của N. meningitidis nhóm huyết thanh B lưu hành ở Việt Nam, qua đó dự đoán được mức độ tương thích của vắc xin 4CMenB với các chủng bản địa.
Gen nhba có mặt ở hầu hết các chủng N. meningitidis và có sự đa dạng rất cao trong quần thể. Kết quả đánh giá sự đa dạng và lưu hành gen nhba trên các chủng N. meningitidis phân lập ở Mỹ (2009 - 2014) cho thấy allele nhba tương đối nguyên vẹn ở các nhóm huyết thanh, 38 peptit NHBA được xác định ở các nhóm huyết thanh B, C, W135 và Y. Số lượng các peptit nhiều nhất gặp ở nhóm huyết thanh B, với 29 loại, peptit 5 và 2 chiếm ưu thế với tỉ lệ tương ứng là 26% và 11%, 20 loại peptit khác có tỉ lệ thấp dưới 5% [11]. Peptit 21, 2 và 17 phổ biến ở các chủng N. meningitidis nhóm huyết thanh B tại Châu Âu (2007 - 2008) [8]. 52 loại peptit khác nhau đã được xác định trong số 300 chủng NMC phân lập tại Tây Ban Nha (2009 - 2010), trong đó 32 peptit chỉ xuất hiện với tỉ lệ dưới 1%. Peptit phổ biến là 17 và 18, chiếm tỉ lệ lần lượt 20,3% và 15,7%, các peptit còn lại chiếm tỉ lệ dưới 10% [14]. Đánh giá mức độ đa dạng kháng nguyên NHBA của 447 chủng N. meningitidis ở miền Tây Austrailia (2000 - 2014) xác định 37 allele mã hóa 33 peptit, các peptit phổ biến là 43, 3, 2 và 20, chiếm tỉ lệ lần lượt 20%, 15%, 15% và 12% [15]. Nghiên cứu trên 172 chủng đại diện N. meiningitidis nhóm huyết thanh B phân lập ở Trung Quốc (1968 - 2016) xác định 68 trình tự axit amin khác nhau, trong đó 34 trình tự mới phát hiện, peptit 20 phổ biến nhất, chiếm 11,6% [13].
Trong nghiên cứu này chúng tôi nhận thấy có sự khác biệt về variant và peptit kháng nguyên NadA cũng như allele và peptit NHBA trên các chủng N. meningitidis nhóm huyết thanh B phân lập ở Việt Nam giai đoạn 2014 - 2024 so với kháng nguyên NadA và NHBA trong vắc xin 4CMenB. Để đánh mức độ bao phủ (tương thích) của vắc xin với các chủng lưu hành nội địa, hệ thống kiểu peptit suy diễn từ 4 kháng nguyên vắc xin 4CMenB: fHbp, PorA, NHBA and NadA (Bexsero Antigen Sequence Type - BAST) được cung cấp từ dữ liệu http://pubmpst.org/neisseria. Nghiên cứu sự đa dạng di truyền 157 chủng NMC nhóm huyết thanh B phân lập tại Canada giai đoạn 2006 - 2009 và đánh giá mức độ bao phủ các kháng nguyên của vắc xin 4CMenB cho thấy mức độ bao phủ của kháng nguyên vắc xin giảm từ 72% (năm 2006) xuống 58% (2008) [17]. Mức độ tương thích các thành phần kháng nguyên trong 4CMenB với chủng N. meningitidis ở hai bang Victoria và Tây Australia giai đoạn 2008 - 2012 lần lượt là 47,1% và 66,4% [18]. Trong số 458 chủng NMC nhóm huyết thanh B phân lập ở 29 tỉnh thành Trung Quốc cho thấy sự đa dạng thành phần kháng nguyên dự tuyển vắc xin 4CMenB và Trumenba [13].
Tại Việt Nam, kết quả nghiên cứu dịch tễ học ca bệnh nhiễm khuẩn xâm nhập do NMC chủ yếu do nhóm huyết thanh B gây ra với tỉ lệ từ 82,6% đến 94% [18, 19]. Chính vì vậy, việc sử dụng vắc xin phổ rộng để dự phòng bệnh nhiễm não mô cầu do nhóm huyết thanh này cho cộng đồng, đặc biệt là trẻ nhỏ và nhóm tuổi vị thành niên là cấp thiết. Từ tháng 2/2024 vắc xin 4CMenB được cấp phép tiêm phòng NMC nhóm huyết thanh B, việc đánh giá mức độ bao phủ 4 kháng nguyên trong vắc xin 4CMenB với 4 kháng nguyên các chủng NMC nhóm huyết thanh B trong nước là cần thiết, qua đó dự báo được khả năng bảo hộ của vắc xin trong cộng đồng. Nghiên cứu này chỉ mới đánh giá được sự phân bố, đặc điểm 2 trong số 4 gen mã hóa kháng nguyên vắc xin 4CMenB trên số lượng mẫu còn hạn chế. Trong nghiên cứu tiếp theo cần đánh giá mức độ đa dạng của gen mã hóa kháng nguyên fHbp và PorA.
5. KẾT LUẬN
Nghiên cứu đặc điểm mã hóa cho kháng nguyên NadA, NHBA của chủng N. meningitidis nhóm huyết thanh B thu thập, phân lập giai đoạn 2014 - 2024 cho thấy tỉ lệ mang gen nadA là 27,9%. 100% thuộc variant 4/5, trong đó peptit 139, 87 chiếm tỉ lệ lần lượt 66,7% và 33,3%. Trong số 83 trình tự gen nhba đã xác định 17 allele đã biết và 2 allele mới mã hóa cho18 peptit. Allele 41 và peptit 16 chiếm tỉ lệ cao nhất lần lượt 61,4% và 55,4%. Có sự khác biệt về variant và peptit kháng nguyên NadA cũng như allele và peptit NHBA trên các chủng N. meningitidis nhóm huyết thanh B phân lập ở Việt Nam giai đoạn 2014 - 2024 so với kháng nguyên NadA và NHBA trong vắc xin 4CMenB.
Lời cảm ơn: Công trình được hoàn thành nhờ sự tài trợ kinh phí của Bộ Khoa học và Công nghệ thông qua đề tài “ Nghiên cứu khai thác và phát triển nguồn gen vi khuẩn Neisseria meningitidis gây bệnh nhiễm não mô cầu”. Mã số NVQG-2019/ĐT.02.
Tuyên bố về đóng góp của các tác giả: Võ Viết Cường thực hiện toàn bộ quá trình viết bản thảo, chỉnh sửa bản thảo. Hoàng Đăng Hiếu tham gia chỉnh sửa bản thảo. Bùi Thị Lan Anh, Trịnh Văn Toàn, Bùi Thị Thanh Nga: Thực hiện thí nghiệm và xử lý số liệu. Triệu Phi Long, Đinh Việt Đức tham gia phối hợp, thu thập chủng Neisseria meningitidis.
Tuyên bố về xung đột lợi ích: Bài báo không có bất kỳ xung đột lợi ích với bất kỳ các tác giả nào.
Tài liệu tham khảo
2. N. G. Rouphael, D. S. Stephens, Neisseria meningitidis: biology, microbiology, and epidemiology, Methods Mol Biol, 799, pp. 1-20, 2012. DOI: 10.1007/978-1-61779-346
3. J. Finne, M. Leinonen, and P. H. Mäkelä, Antigenic similarities between brain components and bacteria causing meningitis: implications for vaccine development and pathogenesis, Lancet, 322(8346), pp. 355-357, 1983. DOI:10.1016/s0140-6736(83)90340-9
4. H. Petousis-Harris, Impact of meningococcal group B OMV vaccines, beyond their brief, Hum Vaccin Immunother, 14(5), pp. 1058-1063, 2018. DOI:10.1080/21645515.2017.1381810
5. A. W. Dretler, N. G. Rouphael and D. S. Stephens, Progress toward the global control of Neisseria meningitidis: 21st century vaccines, current guidelines, and challenges for future vaccine development, Hum Vaccin Immunother, 14(5), pp. 1146-1160, 2018.
6. M. Comanducci, et al., NadA diversity and carriage in Neisseria meningitidis, Infect Immun, 72(7), pp. 4217-23, 2004. DOI: 10.1128/IAI.72.7.4217-4223.2004
7. S. Jacobsson, et al., Sequence constancies and variations in genes encoding three new meningococcal vaccine candidate antigens, Vaccine, 24(12), pp. 2161-8, 2006. DOI: 10.1016/j.vaccine.2005.11.006
8. U. Vogel, et al., Predicted strain coverage of a meningococcal multicomponent vaccine (Bexsero) in Europe: a qualitative and quantitative assessment, Lancet Infect Dis, 13(5), pp. 416-25, 2013. DOI: 10.1016/S1473-3099(13)70006-9
9. L. R. Green, et al., Phase variation of NadA in invasive Neisseria meningitidis isolates impacts on coverage estimates for 4C-MenB, a MenB Vaccine, J. Clin. Microbiol, 56(9), pp. e00204-18, 2018. DOI: 10.1128/JCM.00204-18
10. I. Wasko, et al, Genetic variability of Polish serogroup B meningococci (2010-2016) including the Bexsero vaccine component genes, Vaccine, 38(8), pp. 1943-1952, 2020. DOI: 10.1016/j.vaccine.2020.01.021
11. H. Y. Chang, et al., Distribution of Neisseria meningitidis serogroup b (NmB) vaccine antigens in meningococcal disease causing isolates in the United States during 2009-2014, prior to NmB vaccine licensure, J. Infect, 79(5), pp. 426-434, 2019. DOI: 10.1016/j.jinf.2019.09.001
12. X. Sun, et al., Prevalence and genetic diversity of two adhesion-related genes, pilE and nadA, in Neisseria meningitidis in China, Epidemiol Infect, 141(10), pp. 2163-72, 2013. DOI: 10.1017/S0950268812002944
13. B. Zhu, et al., Prevalence and genetic characteristics of Bexsero and Trumenba vaccine candidates among Neisseria meningitidis serogroup B strains, China, Vaccine, 36(15), pp. 1983-1989, 2018.
14. R. Abad, et al., Predicted strain coverage of a new meningococcal multicomponent vaccine (Bexsero) in Spain: Analysis of the differences with other European countries, PLoS One, 11(3), 2016. DOI: 10.1371/journal.pone.0150721
15. S. Mowlaboccus, et al., Temporal changes in BEXSERO® antigen sequence type associated with genetic lineages of Neisseria meningitidis over a 15-year period in Western Australia, PLoS One, 2016, 11(6), DOI: 10.1371/journal.pone.0158315
16. J. A. Bettinger, et al., Diversity of Canadian meningococcal serogroup B isolates and estimated coverage by an investigational meningococcal serogroup B vaccine (Bexsero), Vaccine, 32(1), pp. 124-30, 2014.
17. S. Mowlaboccus, et al., Differences in the population structure of Neisseria meningitidis in two Australian states: Victoria and Western Australia, PLoS One, 12(10):e0186839, 2017.
18. Nguyễn Đăng Mạnh, et al., Đặc điểm lâm sàng, cận lâm sàng bệnh do cầu khuẩn màng não xâm nhập tại các đơn vị Quân đội từ 2014 đến 2021, Tạp chí Y dược lâm sàng 108, 2021, 16(7):13-19.
19. T. Phan , et al., Characterization of Neisseria meningitidis in Vietnam from 1980s–2019, Int. J. Infect. Dis., vol. 101, 147 p, 2020. DOI.org/10.1016/j.ijid.2020.09.399