ỨNG DỤNG KÍNH HIỂN VI QUANG PHỔ RAMAN TRONG NGHIÊN CỨU SỰ THAY ĐỔI CỦA MÔ DA SAU CỐ ĐỊNH BẰNG FORMALIN
Viện 69, Bộ Tư lệnh Lăng Chủ tịch Hồ Chí Minh
Bộ Tư lệnh Lăng Chủ tịch Hồ Chí Minh
Số điện thoại: 0902691191; Email: thaitu0911@gmail.com
Nội dung chính của bài viết
Tóm tắt (Abstract)
Tóm tắt: Nghiên cứu nhằm đánh giá khả năng ứng dụng kỹ thuật quang phổ Raman trong khảo sát mô da người và phân tích những thay đổi trong cấu trúc hóa học của mô dưới tác động của quá trình cố định bằng formalin. Đối tượng nghiên cứu gồm mô da tươi (chưa cố định) và mô da đã được cố định bằng formalin. Quang phổ Raman được thu nhận từ cả hai nhóm mẫu để phân tích và so sánh sự biến đổi tín hiệu phổ. Kết quả cho thấy phổ Raman của mô da tươi có sự tương đồng cao với các nghiên cứu quốc tế, với các pic đặc trưng tại 855, 933, 1003, 1033 và 1451 cm-¹, đại diện cho các thành phần chính như protein (đặc biệt là collagen), lipid và keratin. Sau cố định, phổ Raman thay đổi rõ rệt: cường độ các pic liên quan đến protein và lipid (856, 933, 1271, 1451, 1653 cm-¹) suy giảm và xuất hiện thêm các pic mới tại 907 và 1492 cm-¹ - là các tín hiệu đặc trưng của formalin. Những thay đổi này cho thấy formalin có thể ảnh hưởng đến độ chính xác của phân tích phổ Raman bằng cách làm nhiễu hoặc làm mất các tín hiệu đặc trưng của mô. Kết quả mở ra tiềm năng ứng dụng quang phổ Raman như một công cụ không xâm lấn trong nghiên cứu và phân tích mô sinh học tại Việt Nam.
ABTRACTS: APPLICATION OF RAMAN MICROSPECTROSCOPY IN THE STUDY OF FORMALIN-FIXED SKIN TISSUE ALTERATIONS
This study aims to evaluate the applicability of Raman spectroscopy in the examination of human skin tissue and to analyze chemical structural changes induced by formalin fixation. The research subjects included both fresh (unfixed) and formalin-fixed human skin tissues. Raman spectra were acquired from both sample groups to analyze and compare spectral signal variations. The results demonstrated that the Raman spectra of fresh skin tissues closely matched those reported in international studies, with characteristic peaks observed at 855, 933, 1003, 1033, and 1451 cm-¹, corresponding to major biochemical components such as proteins (particularly collagen), lipids, and keratin. After fixation, significant spectral changes were observed: the intensities of peaks associated with proteins and lipids (856, 933, 1271, 1451, and 1653 cm-¹) were reduced, and new peaks emerged at 907 and 1492 cm-¹-characteristic signals of formalin. These changes indicate that formalin may compromise the accuracy of Raman spectral analysis by interfering with or masking the tissue’s intrinsic spectral features. The findings highlight the potential of Raman spectroscopy as a non-invasive tool for studying and analyzing biological tissues in Vietnam.
Từ khóa (Keywords)
Quang phổ Raman, mô da, cố định mô, formalin, Raman spectroscopy, skin tissue, tissue fixation
Chi tiết bài viết
- Điểm nổi bật:
Quang phổ Raman là một kĩ thuật hiện đại đã được sử dụng phổ biến trên thế giới trong nghiên cứu y sinh học và chẩn đoán mô bệnh học, tuy nhiên ở Việt Nam lại chưa có bất cứ nghiên cứu ứng dụng quang phổ Raman trong lĩnh vực này.
Nghiên cứu này của chúng tôi là nghiên cứu đầu tiên về quang phổ Raman của mô sinh học nói chung và mô da nói riêng thực hiện tại Việt Nam.
1. ĐẶT VẤN ĐỀ
Trong những năm gần đây, kỹ thuật quang phổ Raman đã được ứng dụng rộng rãi trong nghiên cứu mô bệnh học nhờ khả năng cung cấp thông tin phân tử chuyên sâu mà không cần sử dụng thuốc nhuộm hay xử lý phức tạp mẫu. Nhiều công trình trên thế giới đã chứng minh tiềm năng to lớn của kỹ thuật này trong việc phát hiện sớm và hỗ trợ chẩn đoán các bệnh lý ác tính, đặc biệt là các loại ung thư như ung thư vú [1, 2], ung thư phổi [3-5] và đặc biệt là ung thư da như ung thư biểu mô tế bào đáy (basal cell carcinoma), ung thư hắc tố da (melanoma) và ung thư biểu mô tế bào vảy (squamous cell carcinoma) [6, 7].
Ưu điểm lớn của quang phổ Raman nằm ở khả năng cung cấp "dấu vân tay phân tử" của mẫu mô, từ đó cho phép nhận biết và phân biệt các thành phần sinh học như protein, lipid, carbohydrate, nucleic acid… với độ chính xác cao. Nhờ vậy, quang phổ Raman không chỉ hỗ trợ trong nghiên cứu định tính cấu trúc mô, mà còn có thể định lượng nồng độ các hợp chất trong mẫu sinh học - điều rất quan trọng trong việc theo dõi tiến trình bệnh hoặc đánh giá hiệu quả điều trị.
Tuy nhiên, để đảm bảo kết quả phân tích Raman chính xác và tái lập được, quá trình chuẩn bị mẫu cần được kiểm soát chặt chẽ. Một trong những bước không thể thiếu trong quy trình xử lý mô sinh học hiện nay là cố định mẫu bằng dung dịch formalin. Quá trình cố định giúp duy trì hình thái và cấu trúc mô, ngăn ngừa sự phân hủy trong quá trình lưu trữ hoặc phân tích. Mặc dù vậy, formalin lại có thể tham gia vào các phản ứng hóa học với thành phần mô như protein, collagen, acid nucleic,… tạo ra các sản phẩm mới hoặc làm biến đổi cấu trúc hóa học ban đầu. Những biến đổi này có khả năng gây sai lệch kết quả phân tích Raman, vì các dải phổ mới xuất hiện hoặc cường độ phổ bị thay đổi, khiến cho việc giải đoán dữ liệu Raman gặp khó khăn, đặc biệt trong các nghiên cứu yêu cầu độ chính xác cao như chẩn đoán mô bệnh.
Do đó, việc khảo sát cụ thể ảnh hưởng của formalin đến quang phổ Raman của mô sinh học - trong trường hợp này là mô da - là hết sức cần thiết. Kết quả của nghiên cứu không chỉ góp phần làm rõ mức độ thay đổi về mặt phổ sau cố định, mà còn cung cấp cơ sở để hiệu chỉnh phương pháp xử lý mẫu, từ đó nâng cao độ tin cậy khi ứng dụng kỹ thuật quang phổ Raman trong nghiên cứu mô bệnh học, đặc biệt trong các ứng dụng lâm sàng về chẩn đoán ung thư da.
Xuất phát từ thực tiễn đó, chúng tôi tiến hành nghiên cứu “Phân tích sự thay đổi quang phổ Raman của mô da trước và sau cố định bằng formalin”, với hai nội dung chính:
1. Khảo sát quang phổ Raman của mô da tươi
2. Khảo sát quang phổ Raman của mô da sau cố định bằng dung dịch formalin.
2. ĐỐI TƯỢNG, PHƯƠNG PHÁP NGHIÊN CỨU
2.1 Đối tượng
- 10 mẫu mô da người bình thường chưa qua cố định.
- 10 mẫu mô da người người bình thường đã cố định bằng dung dịch formalin trong 24h.
Các mẫu mô da được lấy từ người hiến, lưu trữ tại viện 69 và đã được thông qua Hội đồng đạo đức theo quy định. Vị trí lấy mẫu là vùng mặt trong đùi. Mô da tươi sau khi lấy được rửa bằng nước muối sinh lý và bảo quản trong thùng lạnh ~ 4ºC. Sau đó mô da tươi được chia làm 2 phần, 1 phần được đo quang phổ trong vòng 6 tiếng kể từ khi lấy mẫu, 1 phần được cố định bằng dung dịch formalin 10% trong 24h sau đó mới đem đi đo quang phổ.
2.2. Phương pháp
Các mẫu mô được chuẩn bị mẫu theo phương pháp cắt lạnh với độ dày lát cắt 15 µm và soi dưới kính hiển vi quang phổ Raman LabRAM soleil v1.0 (Horiba, Nhật Bản), vật kính 50x (NA = 0.6, Nikon), nguồn laser có bước sóng 785 nm, công suất đo 10 mW. Các thông số được cài đặt theo quy trình đã được thông qua tại Viện 69. Mỗi lớp da (thượng bì, chân bì), chúng tôi tiến hành đo tại 3 vị trí gồm 2 vị trí ở vùng rìa 2 bên và 1 vị trí ở trung tâm. Tại mỗi vị trí đó tiến hành đo 3 lần, lấy phổ trung bình để loại bỏ nhiễu do kĩ thuật đo.
Dữ liệu phổ Raman thu được từ các mẫu mô da sau khi đo bằng thiết bị được xử lý nhằm loại bỏ nhiễu, hiệu chỉnh các sai lệch tín hiệu và chuẩn hóa trước khi phân tích. Toàn bộ quá trình xử lý được thực hiện bằng phần mềm LabSpec6 tích hợp trong thiết bị đi kèm. Quá trình xử lý dữ liệu gồm các bước cụ thể như sau:
- Làm mượt tín hiệu (Smoothing): Để giảm nhiễu ngẫu nhiên trên phổ mà không làm mất đi thông tin pic Raman, nghiên cứu áp dụng phương pháp làm mượt Savitzky-Golay. Việc này giúp làm mượt phổ và cải thiện độ phân giải quang phổ trong bước phân tích tiếp theo.
- Hiệu chỉnh đường nền (Baseline Correction): Các phổ Raman thường bị ảnh hưởng bởi huỳnh quang nền, dẫn đến đường nền không bằng phẳng. Phương pháp trừ nền bằng hồi quy đa thức bậc hai (polynomial baseline fitting) được sử dụng để loại bỏ thành phần này, đảm bảo sự chính xác khi xác định vị trí và cường độ các pic Raman.
- Cường độ các pic được chuẩn hóa theo cường độ của pic 1003 cm-1. Phương pháp này dựa trên cơ sở pic 1003 cm-1 của phenylalanin rất ổn định trong mô sinh học, thường ít bị ảnh hưởng bởi formalin nên thường chọn làm chuẩn nội để so sánh cường độ giữa các pic.
3. KẾT QUẢ
3.1. Quang phổ Raman mẫu mô da người bình thường
3.1.1. Quang phổ Raman thượng bì
Kết quả cho thấy quang phổ Raman lớp thượng bì của 10 mẫu mô da có sự tương đồng về vị trí các pic và phù hợp với các nghiên cứu đã được công bố (Bảng 1).
Hình 1. Hình ảnh mô da tươi quan sát dưới kính hiển vi quang phổ Raman, vật kính 10x.
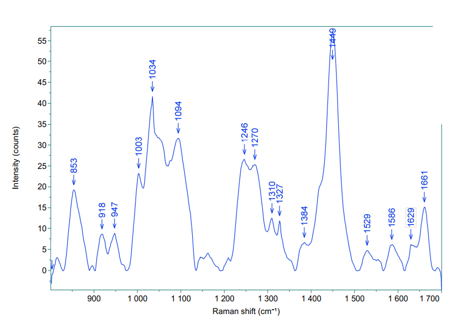
Hình 2. Quang phổ Raman thượng bì mô da tươi.
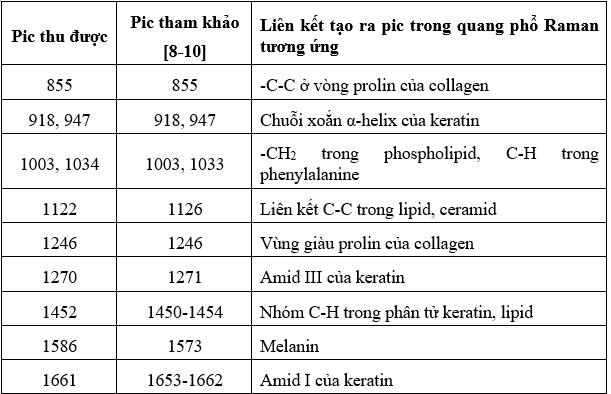
Bảng 1. Các pic đặc trưng của quang phổ Raman của thượng bì mô da tươi
3.2.2. Quang phổ Raman chân bì
Kết quả cho thấy quang phổ Raman lớp chân bì của 10 mẫu mô da có sự tương đồng về vị trí các pic và phù hợp với các nghiên cứu đã được công bố (Bảng 2).
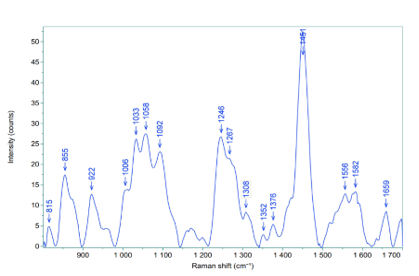
Hình 3. Quang phổ Raman chân bì mô da tươi.
Bảng 2. Các pic đặc trưng của quang phổ Raman của chân bì mô da tươi
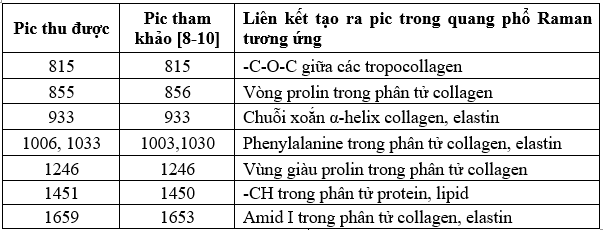
3.1.3. Quang phổ Raman của formaldehyde trong nước
Quang phổ Raman của dung dịch formalin thu được các pic đặc trưng tại các vị trí: 906 cm⁻¹, 1048 cm⁻¹ và 1489 cm⁻¹. Các pic này cho thấy sự hiện diện của các dao động phân tử đặc trưng trong dung dịch và phù hợp với các nghiên cứu đã công bố (Bảng 3).
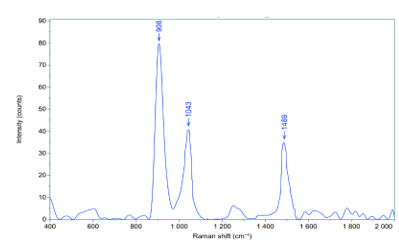
Hình 4. Quang phổ Raman của dung dịch formalin 10%.
Bảng 3. Các pic đặc trưng trong phổ Raman của dung dịch formalin 10%.

3.2. Quang phổ Raman trên mẫu mô da đã cố định formalin
3.2.1. Quang phổ Raman thượng bì đã qua cố định bằng formalin
Kết quả cho thấy quang phổ Raman lớp chân bì của 10 mẫu có sự tương đồng về vị trí các pic và phù hợp với các nghiên cứu đã được công bố (Bảng 4).
Hình 5. Hình ảnh mô da cố định formalin quan sát dưới kính hiển vi quang phổ Raman, vật kính 10x.
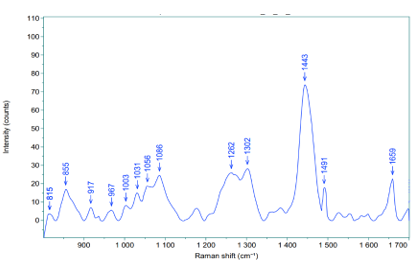
Hình 6. Phổ Raman lớp thượng bì của mẫu mô da được cố định formalin
Bảng 4. Các pic đặc trưng trong phổ Raman của thượng bì 10 mẫu mô da cố định bằng formalin
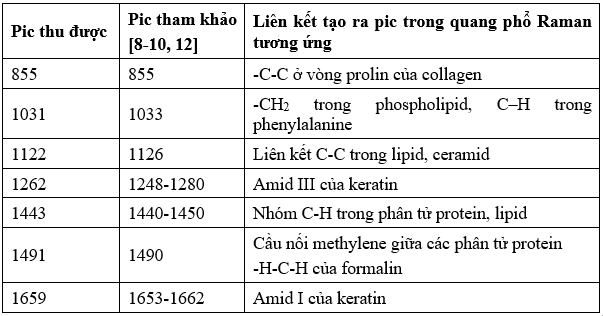
3.2.2. Quang phổ Raman chân bì đã qua cố định bằng formalin
Kết quả cho thấy quang phổ Raman lớp chân bì của 10 mẫu có sự tương đồng về vị trí các pic và phù hợp với các nghiên cứu đã được công bố (Bảng 5).
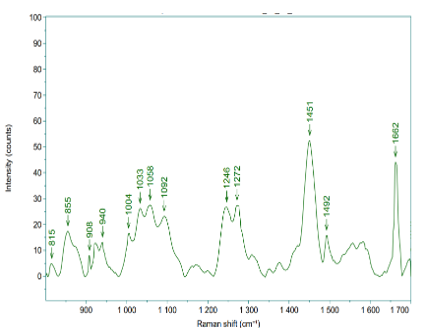
Hình 5. Phổ Raman trung bình chân bì của 10 mẫu mô da tươi được cố định formalin
Bảng 5. Các pic đặc trưng trong phổ Raman của nhú chân bì 10 mẫu mô da cố định formalin
3.3. Cường độ các pic sau cố định formalin
Kết quả so sánh cường độ các pic của mô da trước và sau cố định được trình bày ở Bảng 6.
Bảng 6. So sánh tỉ lệ cường độ các pic của mô da trước và sau cố định.
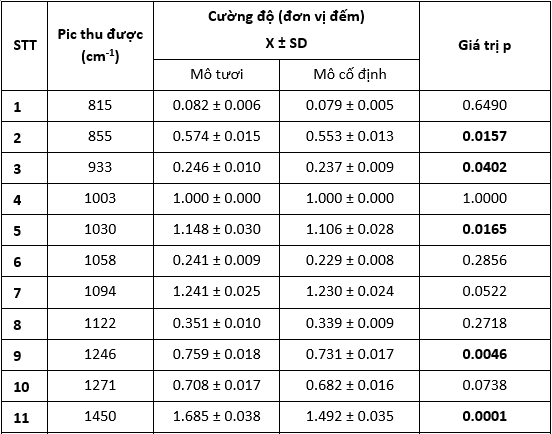
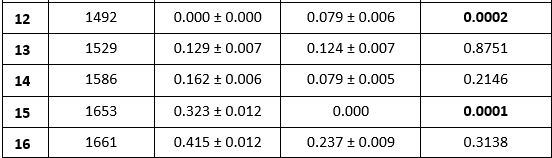
Các ô bôi đậm là các so sánh có ý nghĩa thống kê với p < 0,05.
Kết quả cho thấy 7 pic thay đổi cường độ có ý nghĩa thống kê, trong đó nổi bật là sự xuất hiện của pic 1492 cm-1 và sự biến mất của pic 1653 cm-1.
4. THẢO LUẬN
4.1. Quang phổ Raman trong nghiên cứu mô học da
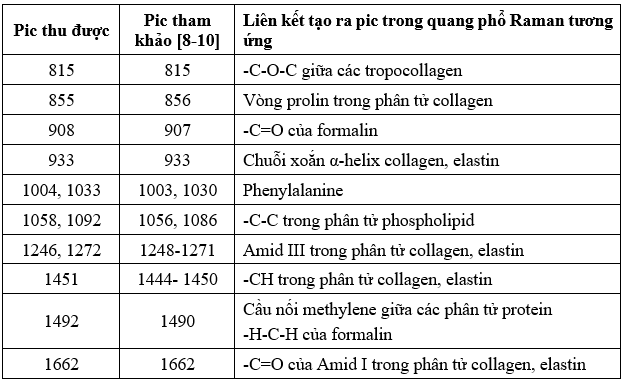
Dựa trên kết quả trong Bảng 3.1 và 3.2, phổ Raman của thượng bì và chân bì mô da cho thấy một số pic phổ chung, như tại 855 (vòng prolin của collagen), 1003 (phenylalanin) và 1246 cm-¹ (amid III). Tuy nhiên, cũng tồn tại các pic đặc trưng riêng biệt, ví dụ như các pic tại 918 cm-¹ và 947 cm-¹, đặc trưng cho cấu trúc xoắn α-helix của keratin, chủ yếu xuất hiện ở thượng bì, trong khi pic tại 815 cm-¹, đặc trưng cho cấu trúc tropocollagen, tập trung ở chân bì. Thêm vào đó, cường độ các pic đặc trưng cho cấu trúc α-helix của keratin có xu hướng cao hơn ở thượng bì và giảm dần ở chân bì, ngược lại, các pic đặc trưng cho collagen type I biểu hiện mạnh hơn ở chân bì và giảm ở thượng bì. Những đặc điểm này phản ánh sự tương quan chặt chẽ giữa cấu trúc mô học của da và phổ Raman thu được. Cụ thể, keratin chiếm thành phần chủ yếu ở thượng bì, trong khi collagen type I là thành phần cấu trúc chính ở chân bì, do sự khác nhau về chức năng và cấu trúc riêng biệt của từng lớp da.
Kết quả nghiên cứu này của chúng tôi về cơ bản phù hợp với các nghiên cứu của T.T.Nguyen năm 2012 [9], Laurence Van Gulick năm 2019 [14] về quang phổ Raman của chân bì mô da và collagen typ I. Điều này cho thấy quang phổ Raman của mỗi chất hay cấu trúc là đặc trưng cho chất hoặc cấu trúc đó. Tuy nhiên kết quả của chúng tôi vẫn có một số khác biệt. Ví dụ, khi đo quang phổ Raman ở chân bì, chúng tôi thu thêm được pic ở vị trí 1556 và 1582 cm-1, có thể do cấu trúc Amid II của protein [15].
Ngoài ra, giá trị tuyệt đối của các pic thu được cũng có sự sai lệch nhỏ so với các nghiên cứu đã được công bố. Phổ Raman của mô sinh học rất nhạy cảm với các yếu tố vật lý và hóa học như nhiệt độ, độ ẩm, độ phân giải của thiết bị đo, cũng như vị trí lấy mẫu. Những yếu tố này có thể tạo ra sự khác biệt nhất định trong kết quả thu được, mặc dù vẫn nằm trong giới hạn cho phép. Mô sinh học có cấu trúc phức tạp, bao gồm nhiều loại phân tử hữu cơ khác nhau cùng tồn tại tại một vị trí đo, dẫn đến khả năng xuất hiện các dải phổ nằm gần nhau. Điều này làm tăng nguy cơ chồng lấn pic, từ đó ảnh hưởng đến độ chính xác trong phân tích dữ liệu phổ. Chẳng hạn, vị trí của dải Raman đặc trưng cho nhóm amid III được ghi nhận dao động trong khoảng 1220 đến 1280 cm-¹, trong khi dải phổ của nhóm amid I cũng có sự biến thiên nhẹ, nằm trong khoảng từ 1634 đến 1673 cm-¹ [16].
4.2. Sự ảnh hưởng của quá trình cố định bằng formalin lên quang phổ Raman của mẫu nghiên cứu
Các pic Raman chính của protein và lipid (ví dụ: 856, 933, 1271, 1451 cm-1) không thay đổi vị trí bởi quá trình cố định formalin, có thể do các cấu trúc phân tử của protein và lipid không bị thay đổi hoàn toàn bởi quá trình này. Tuy nhiên, có sự giảm rõ ràng về cường độ Raman tổng thể của các pic này. Cụ thể, sự giảm cường độ có ý nghĩa thống kê ở các pic 855, 933, 1246 cm-1 của collagen, 1030 cm-1 của phenyalanin và 1450 cm-1 của collagen và lipid. Điều này do formalin phản ứng với với các protein bắt đầu hình thành cộng hợp metylol trên nhóm amin. Sau đó các mảnh gắn metylol vào nhóm amin bậc nhất này bị khử nước, tạo thành bazơ Schiff không bền mà có thể tạo thành các liên kết chéo methylene với một số gốc acid amin như tyrosin [17]. Ngoài ra, quá trình cố định có thể làm thất thoát một phần lipid màng, đặc biệt là lipid mang nhóm amin, kèm theo biến đổi tính toàn vẹn màng, dẫn đến suy giảm tương đối các dải CH₂/CH₃ của lipid (1443-1450 cm-¹) [18].Vì vậy quá trình cố định này làm giảm cường độ các pic liên quan đến dao động của nhóm amid (trong protein) và CH₂ (trong collagen và lipid), đồng thời tạo ra một số pic mới đặc trưng cho bản thân formalin trong phổ Raman tại vị trí 907 và 1492 cm-1 [5, 19]. Chúng tôi còn phát hiện thấy pic 1492 cm-1 xuất hiện ở tất cả các mẫu cố định formalin, tuy nhiên pic 907 cm-1 lại chỉ xuất hiện ở 3/10 mẫu. Có thể do formalin là 1 chất dễ bay hơi nên trong quá trình đo mỗi mẫu 3 lần, thời gian đo kéo dài dẫn đến formalin tự do đã bay hơi, dẫn đến phổ Raman của formalin cũng không xuất hiện. Pic 1492 cm-1 có thể là của cầu nối methylene còn lại trong mô. Giả thuyết này tương tự của Faolain và cộng sự cũng cho rằng sự xuất hiện của pic 1492 cm-1 không chỉ do sự xâm nhập của formalin vào mô mà còn có thể chính là sự xuất hiện của cầu nối methylene [12]. Nói cách khác, ta có thể căn cứ vào vị trí và cường độ của pic 1492 cm-1 để đánh giá sự bảo tồn cầu nối này trong mô. Ngoài ra, pic 1653 cm-1 (đặc trưng cho cấu trúc amid I) không còn xuất hiện ở toàn bộ 10 mẫu nghiên cứu. Kết quả này do formalin đặc biệt thay đổi cấu trúc của amid I [5, 12, 13].
Những thay đổi này có thể gây nhiễu phổ, làm mờ hoặc che khuất các pic cần phân tích, từ đó ảnh hưởng đến độ chính xác trong nhận diện cấu trúc hóa học của mẫu mô. Một số tác giả đã đề xuất có thể rửa mẫu đã cố định bằng dung dịch đệm phốt phát để trung hòa lượng formalin dư, hoặc chuẩn bị mẫu theo phương pháp đông lạnh để hạn chế ảnh hưởng của formalin [13, 19, 20].
Mặt khác collagen typ I là thành phần cấu trúc chủ yếu của mô da, giữ vai trò then chốt trong việc duy trì độ bền cơ học và tính toàn vẹn của tổ chức mô. Khi cố định mô bằng formalin, các phân tử formaldehyde phản ứng với các nhóm amin trong cấu trúc của collagen typ I, tạo liên kết chéo giữa các chuỗi polypeptid. Quá trình này giúp tăng độ bền vững và ổn định hình thái không gian của collagen, qua đó góp phần bảo tồn cấu trúc tổng thể của mô da trong thời gian dài. Do đó, sự hiện diện của các dải phổ đặc trưng của formalin trong phổ Raman của mô cố định không chỉ là biểu hiện của quá trình cố định, mà còn có thể được xem như một chỉ dấu phản ánh mức độ hoàn tất và hiệu quả của việc bảo quản cấu trúc mô, đặc biệt là ở các mẫu lưu trữ lâu dài. Nếu các pic đặc trưng của formalin suy giảm đáng kể hoặc biến mất, điều đó có thể phản ánh tình trạng cố định không còn hiệu quả, từ đó làm cơ sở quyết định có nên bổ sung thêm formalin để đảm bảo chất lượng mẫu được cố định hay không.
5. KẾT LUẬN
- Phổ Raman thu được từ các mẫu mô da tươi trong nghiên cứu của chúng tôi tương tự với kết quả nghiên cứu khác đã được công bố với các pic đặc trưng: 855, 933, 1003, 1033 1451 cm-1 tương ứng với các cấu trúc mô học của da gồm protein (chủ yếu là collagen), lipid và keratin.
- Cố định bằng formalin làm thay đổi phổ Raman của mẫu mô da, gây giảm cường độ pic protein , lipid (856, 933, 1271, 1451, 1653 cm-1) và xuất hiện thêm pic của formalin (907, 1492 cm-1), có thể gây nhiễu hoặc mất tín hiệu cần thiết. Tuy nhiên, các pic formalin cũng giúp đánh giá mức độ cố định mô và quyết định việc bổ sung formalin khi cần thiết.
- Đây là một nghiên cứu mô tả nên chưa thể đưa ra kết luận về mối quan hệ nhân quả giữa các yếu tố được quan sát; các kết quả chỉ dừng lại ở mức độ phát hiện mối liên quan ban đầu, cần được kiểm chứng thêm qua các nghiên cứu với cỡ mẫu lớn hơn và các điều kiện khác trước khi ứng dụng lâm sàng.
Lời cảm ơn: Cảm ơn lãnh đạo chỉ huy Viện 69, Bộ Tư lệnh Lăng Chủ tịch Hồ Chí Minh và tập thể chỉ huy, nhân viên khoa Hình thái, Viện 69; cũng như lãnh đạo Bộ môn Giải phẫu bệnh lý, pháp y, Bệnh viện Quân y 103 đã tạo điều kiện giúp tôi hoàn thành nghiên cứu này.
Tuyên bố về đóng góp của tác giả: Trần Thái Tú:Chịu trách nhiệm xây dựng ý tưởng nghiên cứu, thực hiện các thí nghiệm, phân tích dữ liệu và soạn thảo bản thảo ban đầu của bài báo. Tưởng Phi Vương: Hướng dẫn khoa học, đóng góp vào thiết kế phương pháp nghiên cứu và chỉnh sửa bản thảo.
Tuyên bố về xung đột lợi ích: Các tác giả khẳng định không có bất kỳ xung đột lợi ích nào liên quan đến nghiên cứu, tài trợ, hoặc xuất bản bài báo này.
Tài liệu tham khảo
2. K. Hanna et al., Raman spectroscopy: Current applications in breast cancer diagnosis, challenges and future prospects, British journal of cancer, 126(8), pp. 1125-1139, 2022. DOI: 10.1038/s41416-021-01659-5
3. N.D. Magee et al., Ex vivo diagnosis of lung cancer using a Raman miniprobe, The Journal of Physical Chemistry B, 113(23), pp. 8137-8141, 2009. DOI: 10.1021/jp900379w
4. Z. Huang et al., Effect of formalin fixation on the near-infrared Raman spectroscopy of normal and cancerous human bronchial tissues, International Journal of Oncology, 2003. DOI: 10.3892/ijo.23.3.649
5. Z. Huang et al., Near‐infrared Raman spectroscopy for optical diagnosis of lung cancer, International journal of cancer, 107(6), pp. 1047-1052, 2003. DOI: 10.1002/ijc.11500
6. J. Zhao et al., Using Raman spectroscopy to detect and diagnose skin cancer in vivo, Dermatologic Clinics, 35(4), pp. 495-504, 2017. DOI: 10.1016/j.det.2017.06.010
7. C.A. Lieber et al., In vivo nonmelanoma skin cancer diagnosis using Raman microspectroscopy, Lasers in Surgery and Medicine: The Official Journal of the American Society for Laser Medicine and Surgery, 40(7), pp. 461-467, 2008. DOI: 10.1002/lsm.20653
8. G.C. Limandjaj et al., The keloid disorder: heterogeneity, histopathology, mechanisms and models, Frontiers in cell and developmental biology, 8, 360, 2020. DOI: 10.3389/fcell.2020.00360
9. T.T. Nguyen et al., Characterization of Type I and IV Collagens by Raman Microspectroscopy: Identification of Spectral Markers of the Dermo-Epidermal Junction, Spectroscopy: An International Journal, 27, pp. 421-427, 2012. DOI: 10.1155/2012/686183
10. R. Pereira et al., Diagnosis of squamous cell carcinoma of human skin by Raman spectroscopy, Biomedical Optics 2004. Vol. 5326. SPIE, 2004. DOI: 10.1117/12.528030
11. N. Lebrun et al., Raman analysis of formaldehyde aqueous solutions as a function of concentration, Journal of Raman Spectroscopy, Vol. 34, No.6, pp. 459-464, 2003. DOI: 10.1002/jrs.1025
12. E.O. Faolain et al., A study examining the effects of tissue processing on human tissue sections using vibrational spectroscopy, Vibrational Spectroscopy, Vol. 38, No. 1-2, pp. 121-127, 2005. DOI: 10.1016/j.vibspec.2005.02.013
13. G. Mirizzi et al., Impact of formalin-and cryofixation on Raman spectra of human tissues and strategies for tumor bank inclusion, Molecules, Vol. 29, No. 5, 1167, 2024. DOI: 10.3390/molecules29051167
14. L. Van Gulick et al., Age-related changes in molecular organization of type I collagen in tendon as probed by polarized SHG and Raman microspectroscopy, Sci Rep, Vol. 9, No. 1, p. 7280, 2019. DOI: 10.1038/s41598-019-43636-2
15. B. Barry, H. Edwards and A. Williams, Fourier transform Raman and infrared vibrational study of human skin: assignment of spectral bands, Journal of Raman spectroscopy, Vol. 23, No. 11, pp. 641-645, 1992. DOI: 10.1002/jrs.1250231113
16. Z. Movasaghi, S. Rehman and I.U. Rehman, Raman spectroscopy of biological tissues, Applied Spectroscopy Reviews, Vol. 42, No. 5, pp. 493-541, 2007. DOI: 10.1080/05704920701551530
17. O. J. Gustafsson, G. Arentz and P. Hoffmann, Proteomic developments in the analysis of formalin-fixed tissue, Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, Vol. 1854, No. 6, pp. 559-580, 2015. DOI:10.1016/j.bbapap.2014.10.003
18. D. N. Vos et al., Class-specific depletion of lipid ion signals in tissues upon formalin fixation, International journal of mass spectrometry, Vol. 446, p. 116212, 2019. DOI: 10.1016/j.ijms.2019.116212
19. M. J. Hackett et al., Chemical alterations to murine brain tissue induced by formalin fixation: implications for biospectroscopic imaging and mapping studies of disease pathogenesis, Analyst, Vol. 136, No. 14, p. 2941-2952, 2011. DOI: 10.1039/C0AN00269K
20. I. J. Jahn et al., Sample preparation for Raman microspectroscopy, Physical Sciences Reviews, Vol. 5, No. 1, 2020. DOI: 10.1515/psr-2019-0018