NGHIÊN CỨU ĐẶC TÍNH HẤP PHỤ ION NITRAT TRÊN VẬT LIỆU THAN HOẠT TÍNH ĐƯỢC AMIN HÓA BẰNG (3 - AMINOPROPYL) TRIETHOXYSILAN
Khoa Hóa học, Trường Đại học Khoa học tự nhiên, Đại học Quốc gia Hà Nội
Số 19 Lê Thánh Tông, Hoàn Kiếm, Hà Nội
Nội dung chính của bài viết
Tóm tắt (Abstract)
ADSORPTION CHARACTERISTICS OF NO3- ON AMINE GRAFTED ACTIVATED CARBON USING APTES
In this study, activated carbon was amine-grafted with (3-Amineopropyl) triethoxysilane (APTES) for nitrate adsorption enhancement. Material characterizations by SEM, F-TIR, EDS, Zeta potential measurement, etc. demonstrated the successful amine graft on the activated carbon surface, leading to a charge reversal of the material surface from negative to positive and a superior increase in the NO3- adsorption capacity in comparison with that of bare activated carbon. At the optimal conditions: pH 7, adsorption time of 60 minutes, and adsorbent material of 0.05g, the maximum adsorption capacity of the modified material is relatively high, qmax = 55.21 mg/g. The adsorption of NO3- on the material followed the Langmuir isotherm model and pseudo-second-order kinetics, suggesting that the adsorption included both physical and chemical adsorption processes. When desorbed with 0.5M HCl as the eluting solution, the material could be reused at least 5 times with an adsorption efficiency of ~ 80%. The synthesized material was applied to remove NO3- in some lake water samples in Hanoi with a removal efficiency of ~ 95%.
Từ khóa (Keywords)
Activated carbon, APTES, nitrate adsorption
Chi tiết bài viết
1. ĐẶT VẤN ĐỀ
Ngày nay, với tốc độ phát triển của con người, ô nhiễm nguồn nước đang có xu hướng gia tăng và trở thành vấn đề đáng báo động ở Việt Nam cũng như trên toàn thế giới. Nguồn nước bị ô nhiễm nặng bởi một số hợp chất chứa nitơ, đặc biệt là ô nhiễm nitrat (NO3-) trong môi trường nước đã trở thành vấn đề toàn cầu. Các hoạt động của con người, chẳng hạn như bón phân quá mức trong nông nghiệp là nguồn chính gây ô nhiêm NO3- [1]. NO3- cũng có thể xâm nhập vào nước uống, đe dọa sức khỏe con người [2]. Khi hàm lượng NO3- cao trong cơ thể làm giảm khả năng vận chuyển oxy của máu dẫn đến bệnh xanh da ở trẻ nhỏ (bệnh Blue baby), hội chứng methemoglobin [3, 4]. Tổ chức Y tế Thế Giới (WHO) đã đưa ra giới hạn nồng độ NO3- trong nước uống là 25 mg/L [5]. Ở Việt Nam, nồng độ NO3- trong nước ăn uống cũng được giới hạn tối đa là 50 mg/L theo Quy chuẩn Kỹ thuật Quốc gia về chất lượng nước ăn uống của Bộ Y tế (QCVN 01:2009/BYT).
Việc nghiên cứu và đề xuất các giải pháp để loại bỏ chất gây ô nhiễm này ra khỏi nguồn nước vì vậy là vô cùng cần thiết. Hiện nay, cùng với sự phát triển của khoa học đã có nhiều phương pháp xử lý hàm lượng NO3-trong nước như phương pháp điện phân khử NO3-, phương pháp điện hóa [6], sử dụng màng lọc [7], phương pháp hấp phụ [8-15]. Trong đó, phương pháp hấp phụ có ưu điểm là khả năng làm sạch cao, chất hấp phụ sau khi sử dụng có khả năng tái sinh, việc vận hành khá đơn giản. Các loại vật liệu hấp phụ phổ biến trên thực tế hiện nay có thể kể tên là nhựa trao đổi ion, zeolit, xenlulozơ,… và than hoạt tính. Than hoạt tính là vật liệu hấp phụ rẻ tiền, được sử dụng phổ biến trong thực tế để xử lý nước thải, nhưng hiệu suất hấp phụ NO3- trên than hoạt tính lại chưa cao do bề mặt kị nước. Để có thể tận dụng được loại vật liệu có nguồn gốc thiên nhiên, diện tích bề mặt cao, chi phí thấp và thân thiện với môi trường này, cần biến tính bề mặt than hoạt tính từ kị nước sang ưa nước bằng cách gắn thêm các nhóm chức có tính ưa nước và khả năng trao đổi ion với NO3- như các nhóm amin.
Mục tiêu của nghiên cứu này là biến tính than hoạt tính với (3-Aminopropyl) triethoxysilan (APTES) để hình thành các nhóm amin trên bề mặt (amin hóa bề mặt) và nghiên cứu khả năng hấp phụ nitrat trên vật liệu biến tính. Vật liệu tổ hợp than hoạt tính/APTES được tổng hợp bằng một quy trình khá đơn giản trong đó dung dịch phân tán của than hoạt tính được khuấy trộn đều với dung dịch APTES trong 5 giờ, sau đó được proton hoá trong dung dịch acid để chuyển các nhóm -NH2 thành nhóm -NH3+ mang điện tích dương. Vật liệu than hoạt tính sau khi được amin hoá sẽ cho khả năng hấp phụ nitrat cao nhờ tương tác tĩnh điện giữa nhóm -NH3+ và anion NO3-.
2. ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Hóa chất, thiết bị
Tất cả các hóa chất sử dụng là loại phân tích: dung dịch HCl 36,5% (p.A, Merck, Đức); muối NaNO3 khan (p.A, Merck, Đức); dung dịch APTES 99% (p.A, Merck, Đức); NaOH rắn (p.A, Merck, Đức). Than hoạt tính gáo dừa dạng bột có pH từ 6 - 9, kích thước từ 200 - 325 mesh, độ ẩm ≤ 5%) được mua từ Công ty Cổ phần đầu tư xây dựng và khai thác chuyển giao công nghệ (Việt Nam). Nước deion là nước cất hai lần được lọc qua bộ lọc siêu tinh khiết có cột trao đổi cation, anion và màng lọc 0,2 µm được sử dụng trong các thí nghiệm.
2.2. Tổng hợp vật liệu
Cân 2g than hoạt tính cho vào cốc thủy tinh chịu nhiệt, thêm 5 mL nước deion, 15 mL ethanol 99%, 2 mL APTES. Khuấy trong vòng 5 giờ ở nhiệt độ 70°C, sau đó ly tâm, thu chất rắn và sấy khô thu được vật liệu than phủ APTES. 1 gam chất rắn sấy khô sẽ được khuấy với 100 mL hydrochloric acid 0,5 M trong 2 giờ không gia nhiệt, sau đó ly tâm, sấy khô chất rắn thu được vật liệu than/APTES đã được acid hoá.

Hình 1. Quy trình tổng hợp than hoạt tính/APTES
2.3. Khảo sát đặc trưng của vật liệu
Hình thái bề mặt của vật liệu được quan sát trên kính hiển vi điện tử quét FE-SEM S-4800 (Hitachi, Nhật Bản). Phổ hồng ngoại (IR) trong dải bước sóng 1000 cm-1 đến 4000 cm-1 được ghi trên thiết bị IRAfftinity - 1S (Shimadzu, Nhật Bản). Thành phần của vật liệu được phân tích qua phổ tán sắc năng lượng tia X (EDS) sử dụng thiết bị hiển vi điện tử quét Nova Nano SEM JEC - 3000FC (FEI). Diện tích bề mặt riêng của vật liệu được xác định bằng phương pháp BET trên thiết bị Tristar II Plus, (Micromeritics, Mỹ). Điện tích bề mặt của vật liệu được xác định qua thế Zeta và được đo trên thiết bị Zetasizer Ultra (Malvern Panalytical-Anh).
2.4. Phương pháp xác định nồng độ NO3-
Để xác định nồng độ NO3- trước và sau khi hấp phụ, tiến hành đo độ hấp thụ quang của các dung dịch NO3- ở bước sóng 203 nm trên thiết bị quang phổ UV-VIS (UV-1650 PC, Shimadzu, Nhật Bản) với cuvet thạch anh. Nồng độ NO3- được xác định bằng phương pháp đường chuẩn.
2.5. Nghiên cứu hấp phụ NO3- trên vật liệu than hoạt tính/APTES
Các điều kiện hấp phụ được khảo sát bao gồm: pH của dung dịch, khối lượng chất hấp phụ, thời gian hấp phụ và nồng độ NO3- ban đầu. Chất hấp phụ (0,02-0,12g) được cho tiếp xúc với 10 mL dung dịch NO3- (pH 4÷10) có nồng độ ban đầu từ 10 đến 1000 mg/L. Sau đó, lắc hỗn hợp trong khoảng từ 5-180 phút. Thu lấy dung dịch trong sau khi hấp phụ và đo độ hấp thụ quang ở bước sóng λ = 203 nm.
Hiệu suất hấp phụ (H %) được tính theo công thức:

Dung lượng hấp phụ qe (mg/g) được tính theo công thức:

Trong đó: C0 là nồng độ ban đầu của NO3- (mg/L); Ce là nồng độ NO3- ở trạng thái cân bằng sau khi hấp phụ (mg/L); m là khối lượng của vật liệu hấp phụ (g); V là thể tích của dung dịch NO3- (L).
Các thí nghiệm đẳng nhiệt sử dụng khoảng nồng độ nitrat ban đầu từ 10 đến 1000 (mg/L) ở pH 7,0 và khối lượng chất hấp phụ 0,05 g trong vòng 60 phút. Các thí nghiệm động học được khảo sát trong khoảng thời gian từ 5 đến 180 phút với nồng độ ban đầu là 50 (mg/L) và áp dụng các điều kiện tương tự về pH, khối lượng chất hấp phụ như các thí nghiệm đẳng nhiệt.
2.6. Mô hình hấp phụ
Thực hiện khảo sát mô hình Langmuir và Freundlich cho các nghiên cứu đẳng nhiệt hấp phụ. Mô hình hấp phụ đẳng nhiệt Langmuir được sử dụng để giải thích sự hấp phụ của các loại khí trên bề mặt chất rắn, sau đó được áp dụng cho các hệ thống hấp phụ dung dịch rắn [15].

Trong đó qe là dung lượng hấp phụ tại thời điểm cân bằng (mg/g); qm là dung lượng hấp phụ cực đại (mg/g); KL là hằng số hấp phụ Langmuir (L/mg).
Mô hình hấp phụ đẳng nhiệt Freundlich đặc trưng cho đường đẳng nhiệt hấp phụ đa lớp [16, 17].

Trong đó KF là hằng số hấp phụ Freundlich (L/g); 1/n là chỉ số Freundlich.
2.7 Mô hình động học
Mô hình động học được sử dụng là mô hình biểu kiến bậc 1 và bậc 2.
Mô hình biểu kiến bậc 1:

Mô hình biểu kiến bậc 2:

Trong đó t là thời gian; k1, k2 là các hằng số động học.
2.8. Xử lý mẫu thực
Mẫu nước sau khi lấy cần được xử lý sớm nhất có thể, bảo quản ở nhiệt độ phòng. Trước khi hấp phụ, lọc qua giấy lọc để loại bỏ các tạp chất rắn có trong dung dịch. Xác định nồng độ NO3- trong mẫu, sau đó tiến hành hấp phụ mẫu tại các điều kiện hấp phụ tối ưu (khối lượng vật liệu 0,05 gam, pH 7, thời gian hấp phụ 60 phút, thể tích mẫu nước 10 mL). Xác định nồng độ NO3- còn lại trong dung dịch bằng phương pháp phổ hấp thụ phân tử UV-Vis sử dụng thuốc thử 4- flourophenol.
3. KẾT QUẢ VÀ THẢO LUẬN
3.1. Khảo sát các đặc trưng hóa, lý của vật liệu than hoạt tính/APTES
3.1.1. Xác định thành phần nguyên tố bằng phổ EDS
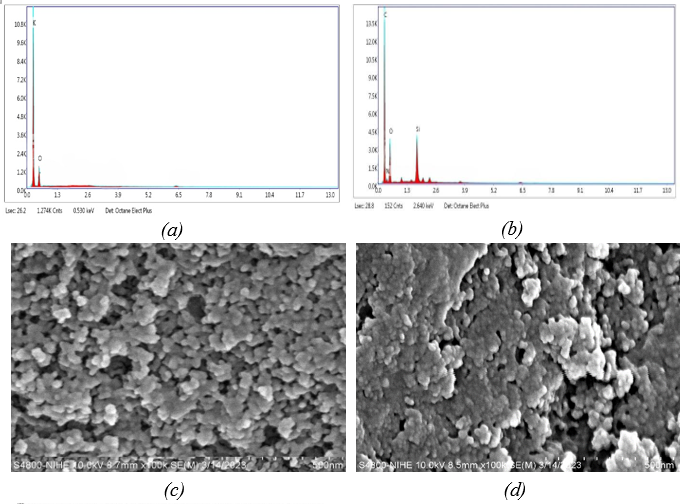
Kết quả đo phổ EDS cho biết sự có mặt của các nguyên tố có trong vật liệu. Phổ EDS của than hoạt tính (Hình 2a) cho thấy sự xuất hiện nhiều nhất của cacbon - nguyên tố cấu thành than hoạt tính. Bên cạnh đó cũng xuất hiện pic đặc trưng của nguyên tố O, chứng minh đã có sự oxi hoá của than trong quá trình hoạt hoá và tạo thành các nhóm chức -COOH và -OH trên bề mặt. Đặc biệt, trong phổ EDS của than hoạt tính/APTES (Hình 2b), bên cạnh các pic đặc trưng của 2 nguyên tố C (68,18%), O (20,95%) còn có sự xuất hiện của các pic đặc trưng cho 2 nguyên tố nitơ (2,83%) và silic (4,88%), chứng minh sự có mặt của APTES trong thành phần của vật liệu.
3.1.2.Khảo sát hình thái bề mặt bằng SEM
Cấu trúc vi mô của than hoạt tính (Hình 2c) và than hoạt tính/APTES (Hình 2d) được thể hiện trong ảnh chụp SEM. Các hạt than hoạt tính khá đồng đều với kích thước khoảng 30 nm. Khi than được biến tính bề mặt bằng APTES, kích thước của vật liệu không thay đổi, cho thấy quy trình biến tính than hoạt tính bằng APTES không làm thay đổi cấu trúc vi mô của vật liệu. Tuy nhiên bề mặt than sau khi biến tính nhẵn hơn, có thể do lớp phủ của APTES trên bề mặt.
3.1.3. Khảo sát nhóm chức bề mặt bằng phổ hồng ngoại
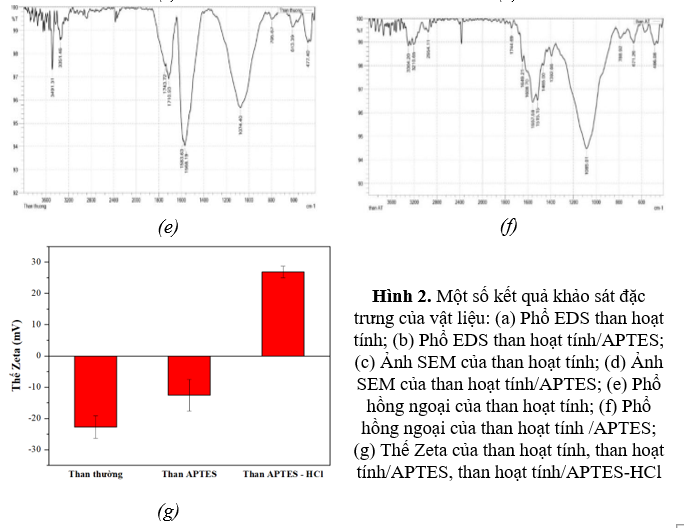
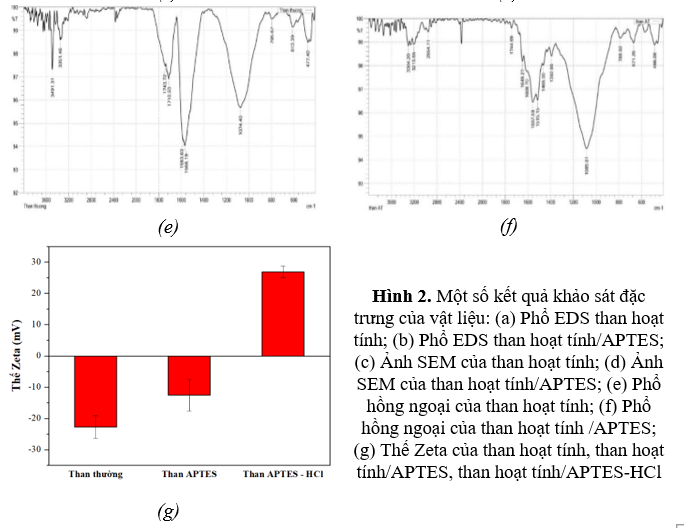
Quan sát phổ hồng ngoại của than hoạt tính (Hình 2e), ta thấy có sự xuất hiện của đỉnh hấp thụ ở vị trí tại 3351 cm-1 đặc trưng cho dao động của nhóm O-H. Đỉnh hấp thụ xuất hiện ở vị trí 1710 cm-1 đặc trưng cho liên kết C=O, còn đỉnh hấp thụ tại 1583 cm-1 là dao động của liên kết C=C vòng thơm. Ngoài ra, sự xuất hiện của đỉnh hấp thụ ở vị trí khoảng 800 cm-1 chứng tỏ có sự xuất hiện của dao động ngoài mặt phẳng của liên kết C-H của vòng thơm.
Sau khi than hoạt tính được biến tính với APTES, trên phổ hồng ngoại của vật liệu (Hình 2f) ngoài các đỉnh đặc trưng của than hoạt tính, xuất hiện các đỉnh ở vị trí 486; 671 cm-1 biểu thị cho dao động của liên kết Si-O-Si; đỉnh ở 2941 cm-1 đặc trưng cho dao động của liên kết C-H lai hóa sp3 trong APTES. Mặt khác, các đỉnh mới xuất hiện ở 3304 cm-1; 671 cm-1 và 1465 cm-1 tương ứng với dao động của N-H, C-H và Si-C, chứng tỏ APTES đã được bao phủ trên bề mặt của than hoạt tính.
3.1.4. Xác định điện tích bề mặt bằng phương pháp đo thế Zeta
Để tiếp tục chứng minh sự amin hoá bề mặt của than hoạt tính bằng việc biến tính với APTES, tiến hành xác định điện tích bề mặt của vật liệu bằng phương pháp đo thế Zeta (Hình 2g). Khi chưa biến tính, bề mặt than hoạt tính mang điện tích âm tương ứng với thế Zeta là -22,77 mV. Điện tích âm này gây ra do sự đề proton hoá của các nhóm chức -OH, -COOH tạo thành do quá trình oxi hoá trên bề mặt vật liệu. Sau khi biến tính với APTES, điện tích bề mặt tăng từ -22,77 mV lên -12,58 mV, có thể do các nhóm -NH2 trên bề mặt đã thế chỗ cho các nhóm carboxylic. Đáng chú ý là sau khi vật liệu được acid hóa bằng HCl mạnh, bề mặt vật liệu chuyển từ điện tích âm sang điện tích dương, tương ứng với sự đảo chiều thế zeta từ -12,58 mV sang +26,84 mV. Sự đảo chiều điện tích bề mặt này gây ra do các nhóm -NH2 khi đó đã bị proton hóa thành các nhóm -NH3+ mang điện tích dương. Việc biến đổi điện tích bề mặt của than hoạt tính từ âm sang dương đóng vai trò rất quan trọng trong việc hấp phụ anion NO3-thông qua tương tác tĩnh điện/ trao đổi ion.
3.1.5. Xác định diện tích bề mặt bằng phương pháp BET
Trong phương pháp hấp phụ, do quá trình hấp phụ xảy ra trên bề mặt vật liệu nên diện tích bề mặt của vật liệu là yếu tố ảnh hưởng rất lớn đến dung lượng hấp phụ. Để làm rõ hơn vai trò của việc biến tính APTES đến sự thay đổi diện tích bề mặt, tiến hành xác định diện tích bề mặt của than hoạt tính và than hoạt tính/APTES bằng phương pháp Brunauer-Emmett-Teller (BET). Kết quả đo cho giá trị diện tích bề mặt riêng của than hoạt tính và của than hoạt tính/APTES lần lượt là 656,3 m²/g và 522,4 m²/g. Như vậy việc biến tính vật liệu than hoạt tính bằng APTES không làm tăng thậm chí còn làm giảm nhẹ diện tích bề mặt của than hoạt tính, có thể do sự bao phủ của 1 lớp mỏng APTES trên bề mặt than hoạt tính làm giảm độ xốp của vật liệu. Kết quả này phù hợp với quan sát về cấu trúc vi mô thông qua ảnh SEM như đã đưa ra ở Mục 3.2.2. Cùng với kết quả đo thế Zeta ở mục 3.1.4, kết quả này cũng cho thấy việc biến tính bằng APTES chủ yếu có hiệu quả trong việc thay đổi điện tích chứ không phải trong việc thay đổi diện tích bề mặt của vật liệu.
3.2. So sánh sự hấp phụ của than hoạt tính, than hoạt tính/APTES và than hoạt tính/APTES acid hoá
Tiến hành so sánh khả năng hấp phụ nitrat của 3 vật liệu than hoạt tính, than hoạt tính/APTES và than hoạt tính/APTES acid hóa để chứng minh quá trình biến tính vật liệu là cần thiết để nâng cao khả năng hấp phụ nitrat. Kết quả so sánh hiệu suất hấp phụ NO3- (0,1 gam vật liệu; nồng độ NO3- 50 ppm, thời gian hấp phụ là 1giờ) cho thấy, trong 3 loại vật liệu, vật liệu than hoạt tính không biến tính có hiệu suất hấp phụ thấp nhất là 3,7%; vật liệu than biến tính trước khi acid hóa cho hiệu suất là 4,5% và vật liệu than biến tính sau khi acid hóa cho hiệu suất vượt trội là 91,6%. Điều này cho thấy: i. việc biến tính bề mặt than hoạt tính bằng APTES sau đó acid hoá có tác dụng rõ rệt trong việc tăng khả năng hấp phụ NO3-; ii. Thay đổi điện tích bề mặt từ đó thúc đẩy tương tác tĩnh điện/trao đổi ion có vai trò quan trọng nhất trong việc tăng cường khả năng hấp phụ NO3- của vật liệu.
3.3. Nghiên cứu các đặc trưng hấp phụ của NO3- trên than hoạt tính/APTES
3.3.1. Ảnh hưởng của pH
pH có thể là một yếu tố quan trọng đối với khả năng hấp phụ nếu bề mặt vật liệu hấp phụ và chất hấp phụ có điện tích phụ thuộc nhiều vào pH. Tuy nhiên khi khảo sát khả năng hấp phụ NO3- của vật liệu than hoạt tính/APTES ở các điều kiện pH khác nhau từ 4 đến 10, nhận thấy không có sự thay đổi đáng kể (Hình 3a). Hiệu suất hấp phụ NO3- đạt giá trị cao nhất Hmax = 91,7% tại pH = 7, sau đó có xu hướng giảm nhẹ xung quanh giá trị 87-88%. Hiệu suất hấp phụ giảm có thể được giải thích do ở pH cao, bề mặt vật liệu mang điện tích âm do hấp phụ các ion OH-; lực đẩy giữa OH- và NO3- làm giảm khả năng hấp phụ của NO3- lên vật liệu. Tương tự, NO3- là anion của acid mạnh nên dạng tồn tại cũng không chịu sự ảnh hưởng của pH. Ảnh hưởng không đáng kể của pH đến hiệu suất hấp phụ có ưu điểm là không cần phải điều chỉnh pH khi xử lý các mẫu thực tế có pH có thể thay đổi trong khoảng rộng từ 4 đến 10. Tuy nhiên, để thống nhất điều kiện đo, trong các thí nghiệm tiếp theo chúng tôi sẽ lựa chọn pH hấp phụ là 7.
3.3.2. Ảnh hưởng của khối lượng vật liệu
Khối lượng vật liệu cũng là một yếu tố ảnh hưởng lớn đến quá trình hấp phụ NO3- thông qua việc quyết định số trung tâm hấp phụ trên bề mặt vật liệu. Như có thể thấy trên Hình 3b, khi thay đổi khối lượng vật liệu từ 0,02 đến 0,12g, hiệu suất hấp phụ có xu hướng tăng do tăng số lượng các trung tâm hấp phụ trên bề mặt vật liệu. Khi khối lượng vật liệu lớn hơn 0,05g, hiệu suất hấp phụ có hiện tượng bão hòa, tương ứng với việc toàn bộ lượng NO3- đã được hấp phụ lên hết các trung tâm hấp phụ trên bề mặt vật liệu. Do đó, 0,05g được chọn là khối lượng vật liệu hấp phụ tối ưu cho các thí nghiệm tiếp theo.
3.3.3. Ảnh hưởng của thời gian hấp phụ
Ảnh hưởng của thời gian hấp phụ đến hiệu suất hấp phụ được khảo sát trong khoảng từ 5 -180 phút (Hình 3c). Từ đồ thị quan sát thấy dung lượng hấp phụ tăng khi tăng thời gian hấp phụ từ 5 đến 60 phút, sau đó dung lượng hấp phụ hầu như không thay đổi và đạt đến cân bằng. Vì vậy, trong các thí nghiệm tiếp theo, thời gian hấp phụ tối ưu được chọn là 60 phút.
3.3.4. Khả năng tái sử dụng vật liệu
Tiến hành đánh giá khả năng tái sử dụng của vật liệu với hai tác nhân rửa giải NO3- là dung dịch NaOH 0,1M và dung dịch HCl 0,1M trong khoảng thời gian 30 phút. Kết quả cho thấy dung dịch HCl 0,1M có khả năng rửa giải vật liệu tốt hơn so với NaOH 0,1 M. Sau 5 lần rửa giải bằng HCl 0,1M và tái hấp phụ, vật liệu vẫn có hiệu suất hấp phụ xấp xỉ 80%, cho thấy tiềm năng tái sử dụng tốt (Hình 3d).
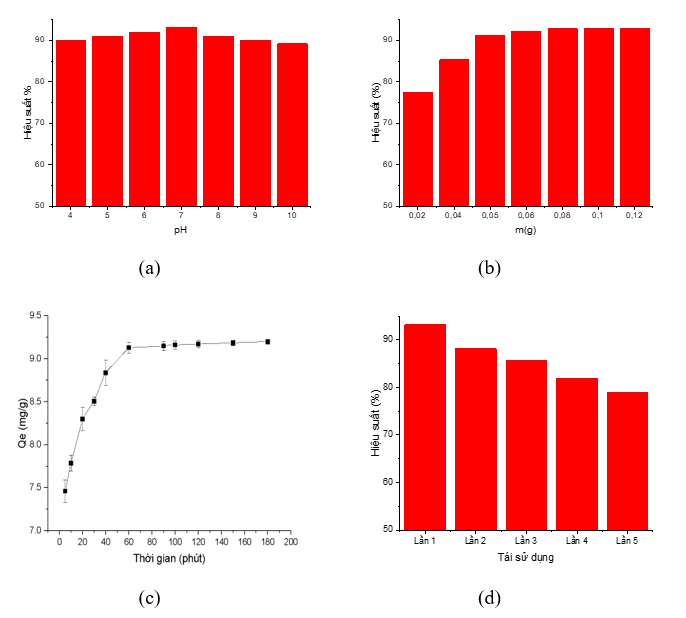
Hình 3. Các yếu tố ảnh hưởng đến khả năng hấp phụ NO3- của vật liệu: (a) Ảnh hưởng của pH; (b) Ảnh hưởng của khối lượng vật liệu; (c) Ảnh hưởng của thời gian hấp phụ; (d) Ảnh hưởng của số lần tái sử dụng
3.4. Nghiên cứu các mô hình hấp phụ
3.4.1. Mô hình đẳng nhiệt hấp phụ
Để xác định sự hấp phụ NO3- trên vật liệu than hoạt tính/APTES tuân theo mô hình Langmuir hay Freundlich, tiến hành khảo sát mối quan hệ giữa nồng độ và dung lượng hấp phụ NO3- trên vật liệu. Biểu diễn số liệu ảnh hưởng của nồng độ NO3- ban đầu theo hai mô hình hấp phụ đẳng nhiệt phổ biến là mô hình Langmuir và mô hình Freundlich (Hình 4a).
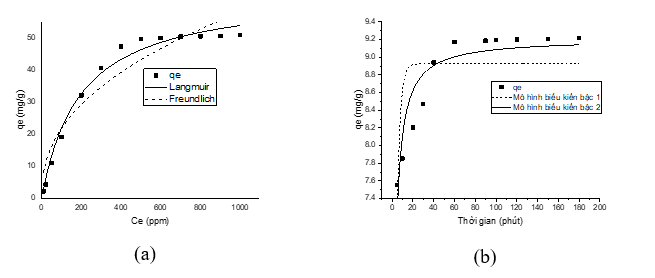
Hình 4. (a) Đường đẳng nhiệt Langmuir và Freundlich; (b)Mô hình biểu kiến bậc 1 và bậc 2
Bảng 1. Thông số của phương trình của mô hình hấp phụ
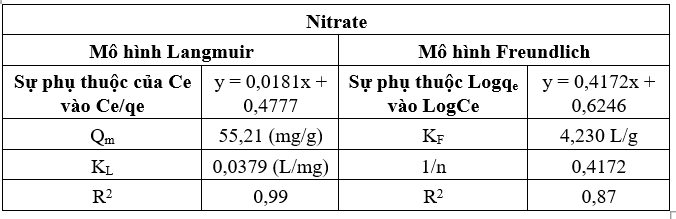
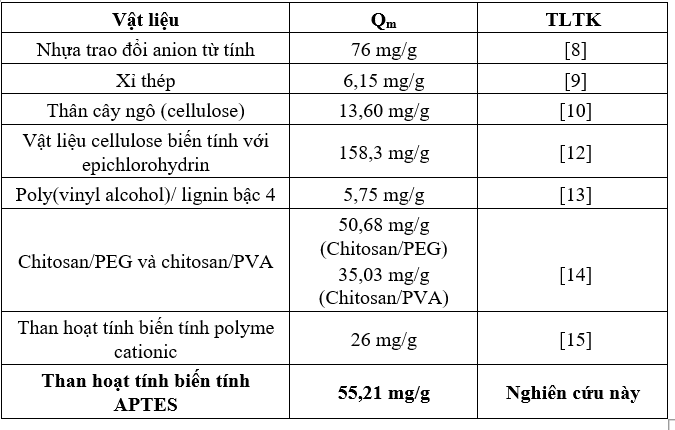
Kết quả thu được cho thấy hệ số tương quan của mô hình Langmuir và Freundlich lần lượt là R2 = 0,99 và R2 = 0,87, cho thấy sự hấp phụ NO3- trên vật liệu là hấp phụ đơn lớp và tuân theo mô hình đẳng nhiệt Langmuir. Dung lượng hấp phụ cực đại được tính toán dựa trên mô hình Langmuir là Qm = 55,21 mg/g. Trong đó: Qm là dung lượng hấp phụ cực đại, KL là hằng số Langmuir thể hiện mức độ ái lực giữa chất hấp phụ và bề mặt chất hấp phụ. KF là hằng số Freundlich thể hiện dung lượng hấp phụ và ái lực của bề mặt đối với chất bị hấp phụ. n là số mũ đặc trưng cho mức độ không đồng nhất của bề mặt và cường độ của quá trình hấp phụ. Khi so sánh giá trị này với các vật liệu khác được sử dụng để hấp phụ NO3- (Bảng 2), có thể thấy dung lượng hấp phụ của vật liệu cao hơn tương đối so với các vật liệu khác như, Xỉ thép (6,15 mg/g); Poly(vinyl alcohol)/ lignin bậc 4 (5,75 mg/g); Chitosan/PEG (50,68 mg/g) và chitosan/PVA (35,03 mg/g); Than hoạt tính biến tính polymer cationic (26 mg/g), cho thấy khả năng hấp phụ của vật liệu là tương đối tốt, có tiềm năng ứng dụng để xử lý các mẫu nước trong thực tế.
Bảng 2. Dung lượng hấp phụ NO3- của một số loại vật liệu trong các nghiên cứu khác nhau
3.4.2. Nghiên cứu mô hình động học hấp phụ
Các thông số động học cung cấp thông tin quan trọng về quá trình hấp phụ để lựa chọn các điều kiện hấp phụ tối ưu. Phân tích 2 mô hình động học biểu kiến bậc một, bậc hai và lựa chọn mô hình phù hợp nhất dựa trên hệ số tương quan. Kết quả cho thấy hệ số tương quan của mô hình biểu kiến bậc hai là 0,91, lớn hơn nhiều so với hệ số tương quan của mô hình biểu kiến bậc một là 0,59 (Hình 4b). Như vậy quá trình hấp phụ tuân theo mô hình biểu kiến bậc hai và sự hấp phụ xảy ra trên 2 trung tâm hấp phụ; nghiêng về hấp phụ hoá học nhiều hơn hấp phụ vật lý.
3.5. Áp dụng xử lý mẫu nước hồ
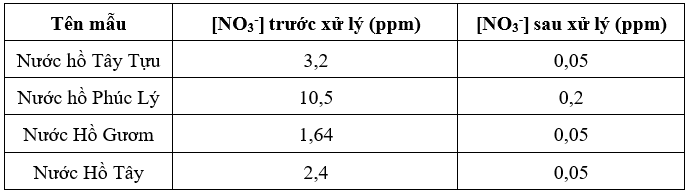
Vật liệu than hoạt tính/APTES được sử dụng để xử lý loại bỏ NO3- trong một số mẫu nước hồ thuộc khu vực Hà Nội. Kết quả hiệu suất xử lý loại bỏ NO3- của các mẫu nước được thể hiện trong Bảng 3. Sau khi xử lý bằng vật liệu than hoạt tính/APTES, nồng độ NO3- trong mẫu nước hồ Phúc Lý giảm từ 10,5 ppm xuống còn 0,2 ppm (tương ứng với hiệu suất xử lý là 95%). Các mẫu nước hồ khác đều giảm dưới LOD của phương pháp là 0,05 ppm. Các kết quả này cho thấy có thể sử dụng vật liệu than hoạt tính/APTES vào ứng dụng trong xử lý nước thải, đặc biệt trong xử lý các anion gây ô nhiễm như NO3-.
Bảng 3. Hiệu quả xử lý NO3- trong một số mẫu nước hồ sử dụng vật liệu than/APTES
4. KẾT LUẬN
Nghiên cứu đã tổng hợp thành công than hoạt tính/APTES với các nhóm -NH2 trên bề mặt và mang điện tích dương sau khi được acid hóa, điều này được xác nhận bằng các phép đo IR, EDS, thế Zeta, BET. Các nhóm amin trên bề mặt than hoạt tính được proton hóa tạo tương tác tĩnh điện với anion NO3- và giúp cho than hoạt tính biến tính với APTES hấp phụ NO3- tốt hơn rất nhiều so với than hoạt tính không được biến tính. Vật liệu biến tính này hấp phụ anion nitrat với dung lượng hấp phụ cực đại cao là 55,21 mg/g. Ngoài ra, vật liệu này có thể tái sử dụng nhiều lần và có tiềm năng ứng dụng trong xử lý nước thải, đặc biệt là để loại bỏ các anion gây ô nhiễm như NO3-.
Tài liệu tham khảo
2. Fields, S., Global nitrogen-cycling out of control, Environ. Health Perspect., 2004, 10(112):A556-A563. DOI:10.1289/ehp.112-a556
3. Funke M.E., Fischetti C.E., Rodino A.M., et al., Methemoglobinemia Induced By Ingesting Lava Lamp Contents", Clin. Pract. Cases. Emerg. Med., 2, 2018 3: 207-210. DOI:10.5811/cpcem.2018.5.38261
4. Knobeloch, L., and M. Protor. "Eight-blue-babies". WMJ 100, 2001, 8:43-47.
5. Orlando U.S., Baes A.U., Nishijima W., et al., Preparation of agricultural residue anion exchangers and its nitrate maximum adsorption capacity, Chemosphere, 2002, 48(10):1041-1046. DOI:10.1016/S0045-6535(02)00147-9
6. Li M., Feng C., Zhang Z., et al., Treatment of nitrate contaminated water using an electrochemical method, Bioresource Technology, 2010, 101(16):6553-6557. DOI:10.1016/j.biortech.2010.03.076
7. Haugen K.S., Semmens M.J., and Novak P.J., A novel in situ technology for the treatment of nitrate contaminated groundwater, Water Research, 2002, 36(14): 3497-3506. DOI:10.1016/S0043-1354(02)00043-X
8. Song H., Yao Z., Shuang C., et al., Accelerated removal of nitrate from aqueous solution by utilizing polyacrylic anion exchange resin with magnetic separation performance, Journal of Industrial and Engineering Chemistry, 2014, 20(5): 2888-2894. DOI:10.1016/j.jiec.2013.11.024
9. Yang L., Yang M., Xu P., et al., Characteristics of nitrate removal from aqueous solution by modified steel slag, Water, 2017, 9(10):757. DOI:10.3390/w9100757
10. C. Fan, Y. Zhang, Adsorption isotherms, kinetics and thermodynamics of nitrate and phosphate in binary systems on a novel adsorbent derived from corn stalks, J. Geochem. Explor., 2018, 188:95-100. DOI:10.1016/j.gexplo.2018.01.020
11. T.S. Anirudhan, T.A. Rauf, Adsorption performance of amine-functionalized cellulose grafted epichlorohydrin for the removal of nitrate from aqueous solutions, J. Ind. Eng. Chem, 2013, 19:1659-1667. DOI:10.1016/j.jiec.2013.01.036
12. I. Aswin Kumar, N. Viswanathan, Development and reuse of amine-grafted chitosan hybrid beads in the retention of nitrate and phosphate, J. Chem. Eng. Data, 2013, 63:147-158. DOI:10.1021/acs.jced.7b00751
13. Y. Li, X. Lin, X. Zhuo, X. Luo, Poly(vinyl alcohol)/quaternized lignin composite absorbent: synthesis, characterization, and application for nitrate adsorption, J. Appl. Polym. Sci., 2013, 128:2746-2752. DOI:10.1002/app.38437
14. A. Rajeswari, A. Amalraj, A. Pius, Adsorption studies for the removal of nitrate using chitosan/PEG and chitosan/PVA polymer composites, J. Water. Process. Eng., 2016, 9:123-134. DOI:10.1016/j.jwpe.2015.12.002
15. D.W. Cho, C.-M. Chon, Y. Kim, B.-H. Jeon, F.W. Schwartz, E.-S. Lee, H. Song, Adsorption of nitrate and Cr(VI) by cationic polymer-modified granular activated carbon, Chem. Eng. J., 2011, 175:298-305. DOI:10.1016/j.cej.2011.09.108
16. Orlando U.S., Baes A.U., Nishijima W., et al., Preparation of agricultural residue anion exchangers and its nitrate maximum adsorption capacity, Chemosphere, 2002, 48(10):1041-1046. DOI:10.1016/S0045-6535(02)00147-9