ĐẶC ĐIỂM SINH HỌC VÀ SINH THÁI HỌC CỦA MỘT SỐ LOÀI NẤM HỌ BOLETACEAE VÀ CHI ENTOLOMA GHI NHẬN TẠI VƯỜN QUỐC GIA TÀ ĐÙNG (ĐẮK NÔNG) VÀ KHU BẢO TỒN THIÊN NHIÊN KON CHƯ RĂNG (GIA LAI)
Viện Sinh thái Nhiệt đới, Trung tâm Nhiệt đới Việt - Nga
Email: giangvietnga@gmail.com
Nội dung chính của bài viết
Tóm tắt (Abstract)
Research on the biological and ecological characteristics of fungi belonging to the Boletaceae and Entolomataceae families (genus Entoloma) has contributed to the description of 4 new species to science belonging to the family Entolomataceae, genus Entoloma: Entoloma cycneum, Entoloma dichroides, Entoloma peristerinumand Entoloma tadungense; 10 new species recorded for the large fungal flora of Vietnam: 7 species of the Boletaceae family: Cyanoboletus flavocontextus, Boletus mirabilis, Phylloporus nigrisquamus, Phylloporus hainanensis, Phylloporus subbacillisporus, Pulveroboletus ridleyi, Kgaria virescens; 3 species belong to the genus Entoloma (family Entolomataceae): Entoloma caespitosum, Entoloma mastoideum and Entoloma omiense. This is the scientific basis to propose solutions and policies for management, conservation and development of large fungal species in particular and biodiversity in general.
Từ khóa (Keywords)
Ta Dung National Park, Kon Chu Rang Nature Reserve, Boletaceae, Entoloma, VQG Tà Đùng, Khu BTTN Kon Chư Răng
Chi tiết bài viết
1. ĐẶT VẤN ĐỀ
Nấm lớn có vai trò quan trọng với hoạt động của các hệ sinh thái trên cạn. Cùng với các sinh vật dị dưỡng khác, chúng tham gia vào quá trình phân hủy các chất hữu cơ chủ yếu có nguồn gốc thực vật, nhiều loài tạo thành nấm rễ với thực vật bậc cao. Nấm đóng vai trò quan trọng trong các chu trình sinh địa hoá và ở nhiều lưới thức ăn, duy trì sự ổn định của hệ sinh thái [1]. Theo Trịnh Tam Kiệt và cộng sự, nếu ước tính số loài nấm có thể có trên lãnh thổ Việt Nam gấp 6 lần số loài thực vật bậc cao thì số loài có thể lên tới 72000 loài. Điều đó có nghĩa là hơn 90% số loài nấm có thể có của Việt Nam còn chưa được định loại và nêu tên trong danh lục [2].
Họ nấm Boletaceae có sợi nấm phát triển và hình thành quả thể lớn, đóng vai trò thiết yếu trong các hệ sinh thái nhiệt đới, hình thành các tổ chức nấm rễ với các loài thực vật họ Dầu (Dipterocarpaceae), họ Đậu (Fabaceae), họ Dẻ (Fagaceae), họ Thông (Pinaceae)… Chúng có thể tiếp cận với các dạng dinh dưỡng mà thực vật không thể sử dụng trực tiếp và nguồn dinh dưỡng tách biệt với rễ cây. Do đó, cây chủ hấp thu tốt hơn các chất dinh dưỡng từ bên ngoài (đặc biệt là môi trường nghèo dinh dưỡng) nhờ liên kết với các sợi nấm và cung cấp cho sợi nấm những thức ăn cần thiết phục vụ cho quá trình quang hợp của chúng. Ngoài ra, nấm cộng sinh với thực vật còn làm tăng khả năng chống chịu với các ảnh hưởng bất lợi của môi trường, cũng như tham gia vào quá trình phân hủy chất hữu cơ. Đối với con người, nhiều loài đóng vai trò làm thực phẩm, nhiều loài chứa hoạt chất sinh học ứng dụng trong y dược. Khu vực Đông Nam Á là trung tâm đa dạng sinh học của các loài nấm thuộc họ Boletaceae [3]. Danh lục đầu tiên tổng hợp tất cả dữ liệu về thành phần loài nấm lớn ở Việt Nam được xuất bản năm 1998 gồm 829 loài, trong đó 10 loài thuộc họ Boletaceae [4]. Năm 2011-2012, sách chuyên khảo mang đầy đủ thông tin nhất cho đến nay về nấm lớn ở Việt Nam đã được xuất bản. Ấn phẩm này cung cấp dữ liệu về sinh thái và phân bố của hơn 900 loài nấm lớn [5, 6], trong đó có dữ liệu tương đối về nấm lớn ở Tây Nguyên. Cho đến nay, ở Việt Nam có khoảng 2500 loài nấm được ghi nhận, trong đó khoảng 1400 loài nấm lớn [2].
Các công trình nghiên cứu về sự đa dạng của các loài nấm lớn ở Tây Nguyên thuộc về Lê Bá Dũng. Ông đã xem xét các nhóm nấm lớn khác nhau, trong đó có một số thông tin về họ Boletaceae [7], dữ liệu từ đó được đưa vào công trình tổng kết về nấm lớn ở Tây Nguyên, mô tả sơ bộ thông tin về 300 loài [8], trong đó khoảng 24 loài nấm thuộc họ Boletaceae.
Entolomataceae là họ lớn nhất trong bộ Agaricales, đặc trưng bởi các lá tia và bào tử màu hồng. Trong nghiên cứu này chúng tôi chỉ đi sâu nghiên cứu chi điển hình nhất là Entoloma, là chi phong phú nhất về loài và đa dạng về hình thái. Đây là chi chiếm phần lớn số loài trong họ Entolomataceae (khoảng hơn 1000 loài), được tìm thấy trong nhiều môi trường sống khác nhau từ đồng cỏ ở Bắc Cực và núi cao cho đến rừng cây lá kim, rụng lá và rừng nhiệt đới [11, 12]. Danh lục tổng hợp đầu tiên của Trịnh Tam Kiệt tóm tắt toàn bộ số liệu về thành phần loài nấmvà nấm mốc ở Việt Nam được công bố năm 1998 bao gồm 829 loài, trong đó chỉ có 6 loài thuộc chi Entoloma [4]. Các loài tương tự được đưa vào Danh mục loài thực vật Việt Nam [9]. Năm 2003, Lê Bá Dũng đã thống kê 300 loài nấm lớn cho vùng Tây Nguyên, trong đó chỉ có hai loài Entoloma là E. lividum và E. madidum [8]. Sau này, Ngô Anh và Nguyễn Thị Kim Cúc đã ghi nhận thêm hai loài thuộc chi này ở tỉnh Thừa Thiên Huế là E. prunuloides (Vườn Quốc gia Bạch Mã) [9] và E. abortivum (Khu Bảo tồn thiên nhiên Phong Điền) [10]. Dữ liệu về khu hệ nấm Việt Nam đã được tóm tắt trong một chuyên khảo xuất bản năm 2011-2012, cung cấp thông tin về sinh thái và phân bố của hơn 900 loài nấm lớn [5, 6] nhưng chỉ có 3 loài thuộc chi Entoloma.
Tây Nguyên nói chung, Vườn Quốc gia (VQG) Tà Đùng (Đắk Nông) và Khu Bảo tồn thiên nhiên (KBTTN) Kon Chư Răng (Gia Lai) nói riêng những là khu vực có diện tích rừng tự nhiên lớn với thảm thực vật đa dạng. Cho đến nay, chưa có công trình nghiên cứu nào công bố đầy đủ và cụ thể về sự đa dạng của họ nấm Thông Boletaceae và chi Entoloma (họ Entolomataceae) ở các khu vực này. Hơn nữa, nạn phá rừng và khai thác lâm sản bừa bãi hiện nay có thể dẫn đến nguy cơ làm nghèo kiệt rừng và thay đổi môi trường sinh thái. Trong bối cảnh hiện nay, việc tiếp tục nghiên cứu chuyên sâu về họ Boletaceae và chi Entoloma (họ Entolomataceae) nói riêng và nấm lớn nói chung trong các hệ sinh thái rừng nhiệt đới Tây Nguyên có giá trị lý luận và thực tiễn. Kết quả nghiên cứu không những thiết lập được danh lục, giải thích tính đa dạng, phân bố các loài nấm trong hai họ này cho khu vực Tây Nguyên, mà còn bổ sung dẫn liệu mới, loài mới cho khoa học và khu hệ nấm Việt Nam. Đây là cơ sở phục vụ đề xuất giải pháp, chính sách quản lý và bảo tồn những loài nấm lớn có giá trị kinh tế và môi trường.
2. ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Đối tượng nghiên cứu
Các loài nấm họ Boletaceae và Entolomataceae ghi nhận tại VQG Tà Đùng và KBTTN Kon Chư Răng.
VQG Tà Đùng: đã tiến hành khảo sát và thu mẫu ở độ cao từ 600 đến 1600 m so với mực nước biển, tại các kiểu rừng hỗn giao, rừng thường xanh và các khu rừng thứsinh đang trong các giai đoạn phục hồi, phần lớn là tre nứa.
KBTTN Kon Chư Răng: đã tiến hành nghiên cứu tại rừng hỗn giao lá rộng lá kim và rừng á nhiệt đới núi thấp (độ cao 1000-1050 m so với mực nước biển), trên các khu vực bằng phẳng và các sườn dốc thoải (độ cao 950-1000 m so với mực nước biển).
2.2. Phương pháp nghiên cứu nấm lớn
* Xác định điểm khảo sát, tuyến khảo sát: Căn cứ vào bản đồ địa hình, thảm thực vật, độ ẩm và các sinh cảnh đặc trưng để chọn các điểm khảo sát thu mẫu. Trong mỗi khu vực thực hiện điều tra lập các tuyến thu mẫu qua các sinh cảnh đặc trưng.
* Phương pháp thu mẫu
Thời gian thu mẫu chủ yếu vào mùa mưa từ tháng 4 đến tháng 7 hằng năm, và một số chuyến thu mẫu vào tháng 9-10 hằng năm.
Thu mẫu nấm theo các sinh cảnh và đai độ cao khác nhau. Dùng dao nhỏ lấy cả phần rễ nấm sâu trong giá thể. Thu mẫu nấm ở các giai đoạn phát triển khác nhau từ non đến trưởng thành. Ghi chép lại màu sắc quả thể khi còn tươi, kích thước mũ, thân, sự thay đổi màu sắc thịt nấm, màu sắc bụi bào tử, mùi, vị, toạ độ thu mẫu, giá thể. Màu sắc nấm được mô tả dựa vào tài liệu của Kornerup A. và Wanscher J. H. [13]. Mẫu vật được chụp tại hiện trường ở các góc độ khác nhau: mặt trên mũ nấm, bào tầng, cuống nấm, thịt nấm. Sấy nấm bằng máy sấy điện ở nhiệt độ 40 - 50oC. Bảo quản nấm trong các túi zip kín với silicagel.
* Phương pháp phân tích hình thái
Nghiên cứu hình thái được thực hiện bằng kính hiển vi ánh sáng AxioScope A1 được trang bị máy ảnh kỹ thuật số Zeiss AxioCam 1Cc3 với phần mềm AxioVisionRel.4.6 (CarlZeiss, Đức). Các bào tử, đảm bào tử và các loại liệt bào được quan sát trong dung dịch 5% KOH hoặc 1% Congo Red trong NH4OH đậm đặc. Kích thước bào tử được tính trung bình dựa trên việc đo kích thước của 20 bào tử khác nhau; kích thước liệt bào và đảm bào tử tính trung bình trên ít nhất 10 đơn vị cho mỗi mẫu nấm. Tỷ lệ chiều dài trên chiều rộng của bào tử được kí hiệu là Q.
* Phương pháp phân tích phân tử
Sử dụng bộ kit tách chuẩn Thermo Scientific Phire Tissue Direct PCR Master Mix (Mỹ) để tách chiết DNA từ các mẫu nấm cần phân tích. Vùng ITS1-5.8S-ITS2 của ribosome nấm được khuếch đại với các mồi đặc hiệu ITS1F và ITS4B [14]. Trình tự nrLSU-rDNA được tạo ra bằng cách sử dụng đoạn mồi LR0R và LR5 [15]. Các đoạn mồi EF1-983F và EF1-1567R được sử dụng để khuếch đại khoảng 500 bp của mồi tef1 [16].
Phản ứng PCR đối với mồi ITS được thực hiện theo các chu kỳ sau: biến tính ban đầu: 98°C trong 4 phút; tiếp theo là 35 chu kỳ: 98°C trong 1 phút, 52°C trong 1 phút và 72°C trong 1 phút và phần mở rộng cuối cùng ở 72°C trong 3 phút. Đối với nrLSU: biến tính ban đầu ở 98°C trong 5 phút; sau đó là 12 chu kỳ biến tính ở 98°C trong 5 giây, ủ ở 67°C trong 1 phút, kéo dài ở 72°C trong 1,5 phút; sau đó là 35 chu kỳ biến tính ở 98°C trong 5 giây, ủ ở 56°C trong 1 phút, kéo dài ở 72°C trong 1,5 phút; và bước mở rộng cuối cùng là 72°C trong 10 phút. Đối với tef1-a: biến tính ban đầu ở 98°C trong 5 phút; sau đó là 8 chu kỳ khử tự nhiên ở 98°C trong 5 giây, ủ ở 60°C trong 40 giây, kéo dài ở 72°C trong 2 phút; sau đó là 36 chu kỳ biến tính ở 98°C trong 5 giây, ủ ở 53°C trong 1,5 phút, kéo dài ở 72°C trong 2 phút; và bước mở rộng cuối cùng là 72°C trong 10 phút.
Kiểm tra các sản phẩm PCR bằng cách sử dụng điện di trên 1% gel agaroseTBE và nhuộm Gel Red, sau đó được tinh sạch bằng Fermentas Genomic DNA Purification Kit (Thermo Fisher Scientific, MA, USA). Giải trình tự được thực hiện với Máy phân tích di truyền mô hình ABI 3500 (Hệ thống sinh học ứng dụng, CA, Hoa Kỳ). Dữ liệu thô được chỉnh sửa và lắp ráp trong MEGA X [17].
3. KẾT QUẢ NGHIÊN CỨU VÀ THẢO LUẬN
3.1. Đa dạng thành phần loài nấm họ Boletaceae và Entolomataceae tại các khu vực nghiên cứu
Kết quả nghiên cứu đã ghi nhận được tổng số 61 loài thuộc 14 chi, 2 họBoletaceae và Entolomataceae trong tổng số 68 mẫu vật thu được ở 2 địa điểm nghiên cứu. Danh lục loài chi tiết được thể hiện ở Bảng 1.
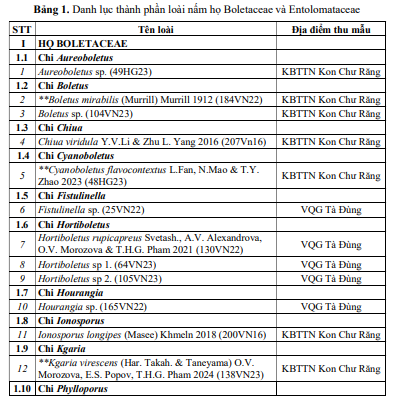
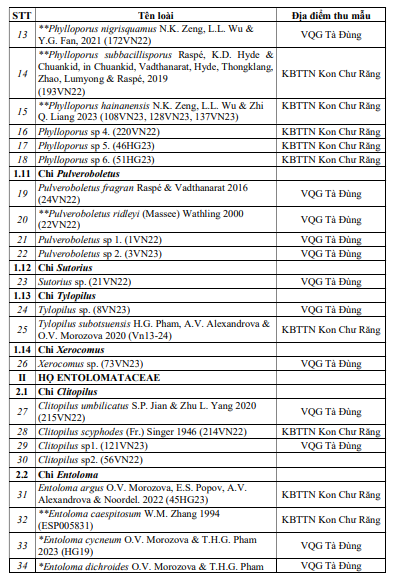
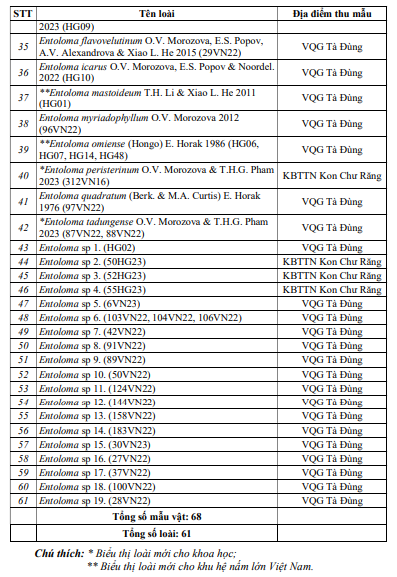
Bảng 1 cho thấy: số loài ghi nhận tại VQG Tà Đùng là: 41 loài, số loài ghi nhận tại KBTTN Kon Chư Răng là 20 loài (dựa vào kết quả giải trình tự AND và xây dựng cây phát sinh, chúng không có sự trùng lặp). Trong đó, không có loài nào ghi nhận ở cả 2 địa điểm nghiên cứu. Vì số lượng mẫu thu được không cao, đa số mỗi mẫu chỉ thu được 1 loài nên chưa thể đưa ra kết luận về phân bố của 2 họ nấm Boletaceae và Entolomataceae trong nghiên cứu này. Tuy nhiên, số loài ghi nhận ở VQG Tà Đùng nhiều gấp đôi so với số loài ghi nhận tại KBTTN Kon Chư Răng có thể giải thích do tính chất khí hậu: VQG Tà Đùng có nền nhiệt cao, không chịu ảnh hưởng của gió mùa đông bắc, trong khi KBTTN Kon Chư Răng mùa đông lạnh, nền nhiệt thấp hơn. Ngoài ra, thảm thực vật tại VQG Tà Đùng phong phú hơn, chủ yếu rừng lá rộng, còn KBTTN Kon Chư Răng địa hình ít phân hoá trên nền bazan nên thảm thực vật kém đa dạng hơn, chủ yếu rừng á nhiệt đới và rừng hỗn giao lá rộng lá kim. Hai yếu tố này rất quan trọng và ảnh hưởng trực tiếp đến sự sinh trưởng, phát triển và hình thành quả thể nấm lớn nói chung và các loài nấm Boletaceae, Entolomataceae nói riêng.
3.2. Đặc điểm sinh học và sinh thái học của các loài mới cho khoa học tại các địa điểm nghiên cứu được nhóm nghiên cứu công bố năm 2023
HỌ ENTOLOMATACEAE Chi Entoloma P. Kumm, 1871.
Đặc điểm hình thái đặc trưng: Bào tử dạng góc cạnh, màu hồng. 1. Entoloma cycneum O. V. Morozova & T.H.G. Pham, 2023.
MycoBank: MB848527.
Quả thể có kích thước nhỏ đến trung bình. Đường kính mũ 10-2,5 mm, ban đầu hình bán cầu, sau đó lồi, mép mũ hơi xoắn sau đó có nếp gấp thẳng, hầu hết nhẵn, nhưng được bao phủ bởi các sợi mỏng ở mép mũ, trong điều kiện ẩm ướt đỉnh mũ gần như trong suốt, màu trắng đến kem (3A1-2; 4A1-2) [13], màu vàng nhạt ở những chỗ bị dập nát, nhạt hơn về phía mép mũ, hơi đậm hơn ở các sọc hút ẩm xuyên tâm, sau đó khô dần thành màu trắng. Phiến nấm cách xa vừa phải, dính liền nhau, có mép đặc, có lỗ, lúc đầu màu trắng, sau có màu kem, hồng nhạt, mép có răng cưa màu trắng. Kích thước cuống 30-60 × 1,5-3 mm, hình trụ, màu trắng, dạng sợi dọc theo chiều dọc hoặc dạng sợi có vảy ở đỉnh, có lông tơ màu trắng ở gốc. Thịt nấm màu trắng hoặc trong suốt. Mùi không rõ ràng, hương vị không được ghi nhận.
Kích thước bào tử (7.2-)8.5-9.0(-9.7) × (7.2-)8.0-8.5(-8.7) μm, Q = 1.0-1.2, hình khối, hiếm khi có 5 góc ở góc nhìn bên. Kích thước đảm 37-50 × 11-12,5 μm, bao gồm 4 bào tử, hình xương đòn, thắt lại ở phần giữa. Liệt bào lá kích thước 95- 160 × 7,5-9 μm, hình trụ uốn cong, đôi khi hình đầu hoặc hình chùy hẹp, có vách ngăn, không sắc tố, có thành phần dạng hạt, tạo thành mép phiến mỏng. Liệt bào lá là lớp biểu bì của sợi nấm hình trụ rộng tới 10 μm. Liệt bào đuôi bao gồm các sợi nấm hình trụ có đường kính sợi tới 7 μm. Lông cuống hình trụ hoặc hơi rộng về phía đỉnh, dài tới 250 μm và rộng 12 μm.
Sinh thái: Mọc đơn độc một cá thể hoặc nhóm nhỏ trên đất rừng hỗn giaothường xanh núi trung bình.
Địa điểm thu mẫu: Tỉnh Gia Lai, Huyện K'Bang, Xã Sơn Lang, KBTTN Kon Chư Răng, toạ độ địa lý 14.49439°N, 108.54591°E, độ cao 990 m so với mực nước biển, trên đất ở rừng hỗn giao núi trung bình với ưu thế của họ Thông (Dacrydium elatum, Dacrycarpus imbricatus), Magnoliaceae, Burseraceae (Canarium), Myrtaceae (Syzygium); Tỉnh Đăk Nông, huyện Đăk Plao, VQG Tà Đùng, phía Đông Nam của núi Tà Đùng, đường mòn dọc theo thung lũng và khu vực phía Đông của núi Tà Đùng, toạ độ 11.87172°N, 108.08253°E, độ cao 1310 m so với mực nước biển, trên đất rừng hỗn giao núi trung bình có sự tham gia của các loài thực vật họ Fagaceae và Lauraceae (Litsea glutinosa).
Phân bố trên thế giới: Loài mới cho khoa học mới ghi nhận tại Việt Nam năm 2023 (kết quả của nghiên cứu này) [18], chưa có tài liệu công bố khác về phân bố của loài này trên thế giới.
2. Entoloma dichroides O. V. Morozova & T.H.G. Pham, 2023.
MycoBank MB 848531.
Quả thể có kích thước trung bình. Đường kính mũ 40 mm, hình nón hoặc hình nón lồi, mép mũ ban đầu lệch sau đó thẳng khi trưởng thành, bề mặt mũ không thấm nước, không có vân trong mờ, màu xanh đậm (20F6-8). Phiến nấm dầy, ban đầu màu trắng chuyển sang màu vàng hồng, sau chuyển sang màu nâu hồng. Cuống nấm kích thước 60 × 3-4 mm, hình trụ, hơi mở rộng ở gốc, rỗng, màu xanh đậm, đồng màu với mũ nấm, bề mặt hình vảy với các sợi màu xanh đậm (20F6-8) [13] trên nền trắng. Thịt nấm trắng. Mùi và vị không xác định.
Bào tử 9,5-12,5 × 6,5-8,5 μm, trung bình 10,8 × 7,2 μm, Q = 1,4-1,6(1,7), Qav = 1,5, bào từ 5-6 góc, dị hình với các góc rõ rệt và đỉnh chóp dài. Kích thước đảm 31-41 × 10-13 μm, bao gồm 4 bào tử. Không tìm thấy liệt bào lá. Liệt bào vỏ gồm các sợi nấm hình trụ rối, đường kính sợi 6-10 μm với các tế bào tận cùng có hình thoi hoặc có hình dạng không đều, kích thước 90-200 × 13-19 μm, với sắc tố nội bào màu xanh đậm. Lông cuống bao gồm các sợi nấm hình trụ cuộn rối với nhau, đường kính sợi 6-12 μm với các tế bào tận cùng hình trụ, đường kính sợi 4-12 μm và dài tới 200 μm, với sắc tố nội bào màu xanh đậm.
Sinh thái: Sống đơn độc trong rừng hỗn giao núi trung bình.
Địa điểm thu mẫu: Tỉnh Đăk Nông, Huyện Đăk Glong, VQG Tà Đùng, phía Tây Bắc núi Tà Đùng, tiểu khu 1781, toạ độ địa lý 11.923056°N, 108.00194°E, độ cao 1000 m so với mực nước biển, trên giá thể đất trong rừng lá rộng với sự có mặt của các loài thực vật: Parashorea chinensis, Rhodoleia championii, Fagaceae, Lauraceae, Hypericaceae.
Phân bố trên thế giới: Loài mới cho khoa học mới ghi nhận tại Việt Nam năm 2023 (kết quả của nghiên cứu này) [18], chưa có tài liệu công bố khác về phân bố của loài này trên thế giới.
3. Entoloma peristernum O.V. Morzova & T.H.G. Pham, 2023.
MycoBank: MB848528.
Quả thể kích thước nhỏ đến trung bình. Đường kính mũ 10-30 mm, quả thể khi non mũ có hình nón cụp, sau đó phát triển rộng tạo thành hình nón với các đường vân rõ ràng, ban đầu lệch tâm sau đó phẳng hoặc hơi nhô, mép hơi khía, hút ẩm, nhẵn, ở trạng thái ẩm ướt gần như có vân trong suốt gần đến tâm, màu kem, màu be nhạt đến màu be hoặc xám-be (4A2; 4B2-3; 5B2-3) [13] nhạt hơn về phía mép mũ, với các sọc hút ẩm xuyên tâm sẫm màu, sau đó khô lại nổi rõ các vân xuyên tâm màu trắng, cuối cùng trở nên trắng hoàn toàn, mịn. Phiến nấm cách nhau vừa phải, có mép, màu kem, màu hồng nhạt, có răng cưa nhỏ ở mép mũ. Cuống nấm có kích thước 30-70 × 1,5-3 mm, hình trụ, rỗng, màu trắng, có sợi dọc hoặc vảy sợi ở đỉnh, có tua vòi màu trắng ở gốc. Thịt nấm màu trắng. Mùi không rõ ràng, hương vị không được ghi nhận.
Kích thước bào tử (7,4-)8-9,5(-9,8) × (6,5-)7-8(-9,2) μm, Q = 1,0-1,2(-1,3), hình khối, hiếm khi có 5 góc khi nhìn từ mặt bên. Đảm bào tử có kích thước 47-60 × 11-14,5 μm, bao gồm 4 bào tử, hình xương đòn, thắt lại ở phần giữa. Kích thước liệt bào lá 75-215 × 12-15 μm, hình trụ hoặc hình xương đòn hẹp hoặc thuôn nhọn về phía đỉnh, thường tạo thành mép phiến mỏng vô trùng. Liệt bào vỏ là lớp biểu bì của sợi nấm hình trụ đường kính tới 10 μm. Liệt bào đuôi bao gồm các sợi nấm hình trụ rộng 4-6 μm, được đan xen bởi các sợi nấm có giọt dầu.
Sinh thái: Mọc thành các nhóm nhỏ trên đất rừng hỗn giao núi trung bình.
Địa điểm thu mẫu: Tỉnh Gia Lai, Huyện K'Bang, Xã Sơn Lang, KBTTN Kon Chư Răng, toạ độ địa lý 14.49439°N, 108.54591°E, độ cao 990 m so với mực nước biển, trên đất ở rừng hỗn giao núi trung bình với ưu thế của họ Thông (Dacrydium elatum, Dacrycarpus imbricatus), Magnoliaceae, Burseraceae (Canarium), Myrtaceae (Syzygium); toạ độ 14.49667°N, 108.56106°E, độ cao 980 m so với mực nước biển; toạ độ 14.49436°N, 108.54428°E, độ cao 1030 m so với mực nước biển
Phân bố trên thế giới: Loài mới cho khoa học mới ghi nhận tại Việt Nam năm 2023 (kết quả của nghiên cứu này) [18], chưa có tài liệu công bố khác về phân bố của loài này trên thế giới.
4. Entoloma tadungense O. V. Morozova & T.H.G. Pham, 2023.
MycoBank: MB848530.
Quả thể kích thước nhỏ. Đường kính mũ 3-10 mm, hình nón hoặc bán cầu, sau đó phát triển phồng lên ở đỉnh, không hút ẩm, không có vân trong mờ, mép mũ gấp khúc sau đó thẳng, dạng sợi xuyên tâm, có vảy ở trung tâm, ban đầu có màu xanh đậm đồng nhất, sau đó chuyển thành màu xanh đen (19F7-8; 20E6 -8; 21F7-8), bề mặt mũ nứt xuyên tâm tạo ra nền trắng (lên đến 20C5-6; D5-6). Phiến nấm mỏng trung bình, có khía rõ ràng, màu trắng, sau đó chuyển sang màu hồng nhạt. Kích thước cuống 1,5- 30 × 0,5-2 mm, hình trụ hoặc mở rộng về phía gốc, ban đầu có các sợi nhỏ theo chiều dọc rõ rệt, màu sáng khi trưởng thành, sau đó bề mặt gần như nhẵn, đặc biệt là ở đỉnh, ban đầu có màu đồng nhất với mũ nấm - xanh đậm, xanh đen (19F7-8; 20E6-8) [13], sau đó chuyển sang màu hoa cà, có lông màu trắng ở gốc. Thịt nấm mỏng, đồng màu với bề mặt mũ. Mùi không rõ ràng, hương vị không được ghi nhận.
Kích thước bào tử (6,0-)6,8-6,9(-8,3) × (4,2-)4,8-4,9(-5,7) μm, Q = 1,3-1,4(- 1,6), dị đối xứng, với 6-7 góc tương đối nhọn khi nhìn từ mặt bên. Kích thước đảm 19,5-24 × 6,6-8,3 μm, bao gồm 4 bào tử, có hai cánh hẹp thành hình trụ dưới. Kích thước liệt bào lá 24-67 × 9-17 μm, dạng xương đòn, thường gặp hơn ở gần mép mũ. Liệt bào được tạo thành từ các sợi nấm hình trụ, hẹp, kích thước sợi tới 3 μm. Liệt bào vỏ là một lớp biểu bì với các sợi nấm hình trụ đến hoặc hơi phồng, đường kính sợi lên đến 10-20 μm với sắc tố nội bào màu xanh lam. Lông cuống là một lớp biểu bì cấu tạo từ các sợi nấm có đường kính 5 μm.
Sinh thái: Mọc thành các nhóm nhỏ trên đất ở rừng hỗn giao núi trung bình.
Địa điểm thu mẫu: Tỉnh Đăk Nông, huyện Đăk Glong, VQG Tà Đùng, phía Đông Nam sườn núi Tà Đùng, tiểu khu 1805, toạ độ địa lý 11.86780°N, 108.11692°E, độ cao 1240 m so với mực nước biển, trên đất ở rừng lá rộng thường xanh với sự có mặt của các loài thực vật Lithocarpus spp., Quercus sp., Schima sp., Dilleniaceae, Myristicaceae, Acer flabellatum…Phân bố trên thế giới: Loài mới cho khoa học mới ghi nhận tại Việt Nam năm 2023 (kết quả của nghiên cứu này) [18], chưa có tài liệu công bố khác về phân bố của loài này trên thế giới.

Các biện pháp bảo tồn
Một phần đáng kể các loài thuộc họ Boletaceae và Entolomataceae được xác định ở Tây Nguyên đã được mô tả trong thập kỷ qua và chúng tôi ghi nhận chúng lần đầu tiên ở Việt Nam nên hiện tại chưa thể kết luận về mức độ quý hiếm của chúng. Sách đỏ Việt Nam có một loài nấm boletus - Boletus edulis, được tìm thấy ở miền Bắc Việt Nam tuy nhiên, chúng tôi chưa phát hiện được trong quá trình nghiên cứu.
Phương pháp đáng tin cậy duy nhất để bảo tồn nấm Boletaceae và Entolomataceae cũng như các loài nấm khác chính là bảo tồn môi trường sống của chúng. Bảo vệ rừng và tăng diện tích không gian xanh là biện pháp quan trọng để bảo tồn môi trường sống của các loại nấm, trong đó có các loài nấm quý hiếm. Nuôi trồng các loài nấm quý hiếm trong phòng thí nghiệm, nuôi cấy thuần khiết, sau đó đưa chúng trở lại môi trường sống tự nhiên là một trong những cách bảo tồn đang được các nhà nghiên cứu sinh thái quan tâm (bảo tồn ex situ), tuy nhiên hiện nay phương pháp này chưa phù hợp với các loài nấm mycorrhiza, trong đó có các loài thuộc họ Boletaceae và Entolomataceae. Rất nhiều nghiên cứu về nuôi cấy thuần khiết nấm rễ mycorrhiza đã được tiến hành nhưng chưa thành công.
4. KẾT LUẬN
Đã ghi nhận 61 loài thuộc 14 chi, 2 họ Boletaceae và Entolomataceae trên tổng số 68 mẫu vật thu được ở VQG Tà Đùng (Đắk Nông) và KBTTN Kon Chư Răng (Gia Lai). Trong đó, 26 loài nấm thuộc họ Boletaceae và 35 loài nấm thuộc họ Entolomataceae (31 loài thuộc chi Entoloma, 4 loài thuộc chi Clitopilus). Ghi nhận 4 loài nấm mới cho khoa học thuộc họ Entolomataceae, chi Entoloma: Entoloma cycneum, Entoloma dichroides, Entoloma peristerinum vàEntoloma tadungense.
Lập danh lục 20 loài nấm thuộc họ Boletaceae và chi Entoloma tại VQG Tà Đùng và KBTTN Kon Chư Răng, trong đó 10 loài ghi nhận mới cho khu hệ nấm lớn Việt Nam: 7 loài thuộc họ Boletaceae: Cyanoboletus flavocontextus, Boletus mirabilis, Phylloporus nigrisquamus, Phylloporus hainanensis, Phylloporus subbacillisporus, Pulveroboletus ridleyi, Kgaria virescens. 3 loài thuộc chi Entoloma(họ Entolomataceae): Entoloma caespitosum, Entoloma mastoideum, Entoloma omiense.

Tài liệu tham khảo
2. Trịnh Tam Kiệt, Trịnh Tam Bảo. (2011). Đa dạng sinh học nấm Việt Nam và giá trị tài nguyên của chúng. Hội nghị Khoa học toàn quốc về Sinh thái và Tài nguyên sinh vật lần thứ nhất tại Hà Nội, tr. 97-104.
3. Фам Тхи Ха Жанг, Е. С. Попов, О. В. Морозова, Нгуен Данг Хой. (2018). История изучения базидиальных макромицентов Центрального нагорья Вьетнама. *Микология и фитопатология*, 52(5), 306-318. DOI: 10.1134/S0026364818050033.
4. Trinh Tam Kiet. (1998). Preliminary checklist of macrofungi of Vietnam. *Feddes Repertorium*, 109(3-4), 257-277. DOI: 10.1002/fedr.19981090309.
5. Trịnh Tam Kiệt. (2011). Nấm lớn ở Việt Nam, Tập 1. NXB Khoa học và Kỹ thuật Hà Nội.
6. Trịnh Tam Kiệt. (2012). Nấm lớn ở Việt Nam, Tập 2. NXB Khoa học và Kỹ thuật Hà Nội.
7. Lê Bá Dũng. (2003). Nấm lớn ở Tây Nguyên. NXB Khoa học và Kỹ thuật, tr. 115-261.
8. Lê Bá Dũng. (2001). Mycoflora of Family Boletaceae of Highland area. *VNU J. Sci., Nat. Sci. Technol.* (Hanoi), 17(2), 25-28.
9. Ngô Anh. (2006). Sự đa dạng của khu hệ nấm lớn ở VQG Bạch Mã, tỉnh Thừa Thiên Huế. *Tạp chí Nghiên cứu và Phát triển*, 1(54), 46-52.
10. Ngô Anh, Nguyễn Thị Kim Cúc. (2013). Sự đa dạng nấm lớn khu bảo tồn thiên nhiên Phong Điền tỉnh Thừa Thiên Huế. Hội nghị Khoa học toàn quốc về Sinh thái và Tài nguyên sinh vật lần thứ 5, Hà Nội, tr. 346-370.
11. Co-David, D., Langeveld, D., & Noordeloos, M. E. (2009). Molecular phylogeny and spore evolution of Entolomataceae. *Persoonia*, 23, 147-176. DOI: 10.3767/003158509X480944.
12. Baroni, T. J., & Matheny, P. B. (2011). A reevaluation of gasteroid and cyphelloid species of Entolomataceae from eastern North America. *Harvard Papers in Botany*, 16(2), 293-310. DOI: 10.2307/41761716.
13. Kornerup, A., & Wanscher, J. H. (1978). *Methuen Handbook of Colour* (3rd ed.). Eyre Methuen: London, UK, 252pp.
14. Gardes, M., & Bruns, T. D. (1993). ITS primers with enhanced specificity for basidiomycetes application to the identification of mycorrhizae and rusts. *Mol. Ecol.*, 2, 113-118. https://doi.org/10.1111/j.1365-294X.1993.tb00005.x.
15. Vilgalys, R., & Hester, M. (1990). Rapid genetic identification and mapping of enzymatically amplified ribosomal DNA from several Cryptococcus species. *J. Bacteriol.*, 172, 4238-4246. DOI: 10.1128/jb.172.8.4238-4246.1990.
16. Rehner, S. A., & Buckley, E. A. (2005). Beauveria phylogeny inferred from nuclear ITS and EF1-a sequences: Evidence for cryptic diversification and links to Cordyceps teleomorphs. *Mycologia*, 97, 84-98. DOI: 10.3852/mycologia.97.1.84.
17. Kumar, S., Stecher, G., Li, M., Knyaz, C., & Tamura, K. (2018). MEGA X: Molecular evolutionary genetics analysis across computing platforms. *Mol. Biol. Evol.*, 35, 1547-1549. DOI: 10.1093/molbev/msy096.
18. Olga Morozova and Thi Ha Giang Pham. (2023). New species of Entoloma subgenera Cubospora and Leptonia (Agaricales, Basidiomycota) from Central Vietnam. *Journal of Fungi*, 9, 621. https://doi.org/10.3390/jof9060621.
19. Wu, G., Li, Y. C., Zhu, X. T., Zhao, K., Han, L. H., Cui, Y. Y., Li, F., Xu, J. P., & Yang, Z. L. (2016). One hundred noteworthy boletes from China. *Fungal Diversity*, 81, 25-188. DOI: 10.1007/s13225-016-0375-8.
20. Fan, L., Mao, N., & Zhao, T. Y. (2023). Boletaceae from Shanxi Province of northern China with descriptions of ten new species. *Mycosphere*, 14(1), 2034. DOI: 10.5943/mycosphere/14/1/24.
21. Danny Haelewaters, et al. (2021). Fungal systematics and evolution: FUSE 8. *Sydowia*, 74, 227-230. DOI: 10.12905/0380.sydowia74-2021-0193.
22. Khmelnitsky, O., Davoodian, N., Singh, P., Raspé, O., Lee, S. M. L., Fechner, N., & Halling, R. E. (2019). Ionosporus: a new genus for Boletus longipes (Boletaceae), with a new species, I. australis, from Australia. *Mycological Progress*, 18(3), 439-451. DOI: 10.1007/s11557-018-01463-1.
23. Har. Takah. & Taneyama. (2016). The fungal flora in southwestern Japan, Agarics and boletes. 1, 45.
24. Zeng, N. K., Liang, Z. Q., & Su, M. S. (2018). Tylopilus callainus, a new species with a sea-green color change of hymenophore and context from the south of China. *Phytotaxa*, 343(3), 271. https://doi.org/10.11646/phytotaxa.343.3.7.
25. Zeng, N. K., Wu, L. L., & Liang, Z. Q. (2023). The subfamily Xerocomoidea (Boletaceae, Boletales) in China. *Stud. Mycol.*, 106, 170. DOI: 10.3114/sim.2023.106.03.
26. Zeng, N. K., Wu, L. L., & Fan, Y. G. (2021). Updated taxonomy of Chinese phylloporus (Boletaceae, Boletales): six new taxa and four redescribed species. *Mycol. Progr.*, 20(10), 1264. https://doi.org/10.1007/s11557-021-01722-8.
27. Raspé, O., Vadthanarat, S., De Kesel, A., Degreef, J., Hyde, K. D., Lumyong, S. (2019). Three new Phylloporus species from tropical China and Thailand. *Mycol. Progr.*, 18(5), 608. DOI: 10.1007/s11557-019-01474-6.
28. Raspé, O., Vadthanarat, S., De Kesel, A., Degreef, J., Hyde, K. D., & Lumyong, S. (2016). Pulveroboletus fragrans, a new Boletaceae species from Northern Thailand, with a remarkable aromatic odor. *Mycological Progress*, 15, 38. https://doi.org/10.1007/s11557-016-1179-7.
29. Watling, R. (2000). Bresadola, Cesati and patouillard's old world boletes. In: *Micologia*, p. 580. https://doi.org/10.1017/S0953756201004877.
30. Crous, P. W., et al. (2020). Fungal planet description sheets: 1112-1181. *Persoonia*, 45, 396-397. https://doi.org/10.3767/persoonia.2020.45.10.
31. Morozova, O., Popov, E., Alexandrova, A., Pham, T. H. G., & Noordeloos, M. E. (2022). Four new species of Entoloma (Entolomataceae, Agaricomycetes) subgenera Cyanula and Claudopus from Vietnam and their phylogenetic position. *Phytotaxa*, 549, 1-21. DOI: 10.11646/phytotaxa.549.1.1.
32. Zhang, W. M., Li, T. H., Bi, Z. S., & Zheng, G. Y. (1994). Taxonomic studies on the genus Entoloma from Hainan Province of China (I). *Acta Mycologica Sinica*, 13, 188-196. DOI: 10.1016/j.myc.2013.06.002.
33. Crous, P. W., Wingfield, M. J., Guarro, J., Hernández-Restrepo, M., Sutton, D. A., Acharya, K., & Groenewald, J. Z. (2015). Fungal planet description sheets: 320-370. *Persoonia*, 34, 167-266. DOI: 10.3767/003158515X688433.
34. He, X. L., Li, T. H., Jiang, Z. D., & Shen, Y. H. (2011). Entoloma mastoideum and E. praegracile - two new species from China. *Mycotaxon*, 116, 413-419. http://dx.doi.org/10.5248/116.413.
35. Morozova, O. V., Popov, E. S., & Kovalenko, A. E. (2012). Studies on mycobiota of Vietnam. I. Genus Entoloma: New records and new species. *Mikol. Fitopatol.*, 46, 184-200.
36. Hongo, T. (1989). Selected Mycological papers of Dr. Tsuguo Hongo. Shiga University, Otsu, Japan, 362pp.
37. Horak, E. (1976). On cuboid-spored species of Entoloma (Agaricales). *Sydowia*, 28(1-6), 190.
38. Trinh Tam Kiet. (2008). Poisonous mushroom of Viet Nam. *Genetics and Applications*, 4, 70-73. DOI: 10.51298/vmj.v502i2.677.
39. Trần Thị Thu Hiền, Trần Huy Thái, Lê Bá Dũng, Thái Văn Tài, & Nguyễn Phương Đại Nguyên. (2015). Kết quả nghiên cứu thành phần loài nấm độc ở Khu Bảo tồn thiên nhiên Nam Kar tỉnh Đắk Lắk. Hội nghị Khoa học toàn quốc về Sinh thái và Tài nguyên sinh vật lần thứ 5, Hà Nội, tr. 1120-1124.
40. Đỗ Hữu Thư, & Nguyễn Phương Đại Nguyên. (2017). Thành phần loài nấm có giá trị thực phẩm thuộc chi Boletus ở Vườn Quốc gia Chư Yang Sin, tỉnh Đắk Lắk. Hội Thảo toàn quốc về Sinh thái và Tài nguyên sinh vật lần thứ 7, Hà Nội, tr. 1489-1495.
41. Chen, Z., Zhang, P., & Zhang, Z. (2014). Investigation and analysis of 102 mushroom poisoning cases in southern China from 1994 to 2012. *Fungal Diversity*, 64(1), 123-131. DOI: 10.1007/s13225-013-0260-7.
42. Wu, L. L., Liang, Z. Q., Xue, R., Fan, Y. G., Jiang, S., Fu, Y. Q., & Zeng, N. K., Su, M. S. (2019). The genus Crocinoboletus (Boletaceae, Boletales): a new species and updated information for previously described species. *Phytotaxa*, 419(1), 91-99. DOI: 10.11646/phytotaxa.419.1.6.
43. Mao, Xiaolan. (2000). The macrofungi in China. NXB Khoa học và Kỹ thuật Hà Nam, ISBN 7-5349-2176-7. 719pp.
44. Laessoe, T., Pedersen, O. S., & Sysouphanthong, P. (2018). An introduction to the edible, poisonous and medicinal fungi of Northern Laos. Vientiane, 192pp.
45. Benjamin, Denis R. (1995). Mushrooms: Poisons and Panaceas - A handbook for naturalists, mycologists and physicians. New York: WH Freeman and Company. ISBN: 0-7167-2600-9.
46. Li, H., Zhang, H., Zhang, Y., Zhang, K., Zhou, J., Yin, Y., Jiang, S., Ma, P., He, Q., Zhang, Y., Wen, K., Yuan, Y., Lang, N., Lu, J., & Sun, C. (2020). Mushroom poisoning outbreaks - China, 2019[J]. *China CDC Weekly*, 2(2), 19-24. DOI: 10.46234/ccdcw2020.005.
47. Braeuer, S., Goessler, W., Kameník, J., Konvalinková, T., Ţigová, A., & Borovička, J. (2018). Arsenic hyperaccumulation and speciation in the edible ink stain bolete (Cyanoboletus pulverulentus). *Food Chemistry*, 242, 225-231. DOI: 10.1016/j.foodchem.2017.09.038.