TỐI ƯU HÓA ĐIỀU KIỆN CHIẾT XUẤT BÀI THUỐC SINH MẠCH TÁN BẰNG PHƯƠNG PHÁP BỀ MẶT ĐÁP ỨNG
Viện Y sinh Nhiệt đới, Trung tâm Nhiệt đới Việt - Nga, Học viện Khoa học và Công nghệ - Viện Hàn lâm Khoa học và Công nghệViệt Nam
Nội dung chính của bài viết
Tóm tắt (Abstract)
The aim of the study is to optimize the extraction process from Shengmai San using the Response Surface Methodology (RSM). The factors of ethanol concentration, temperature, and extraction time have an impact on the performance of extraction (PE) and the anti-free radical activity DPPH %I (p<0.05). The method used was regression analysis of experimental data, resulting in a second-degree polynomial model with a relatively strong correlation to variance analysis that is statistically significant (p<0.05), and high R2R^2, Radj2R^2_{adj} values, indicating a reliable and suitable model for real-world application.
The results determined the optimal conditions of RSM as follows: ethanol concentration of 67.0%; temperature of 62.2°C; and extraction time of 2.9 hours. The expected optimal values for PE and DPPH %I under these conditions are 32.6% and 78.4%, respectively. To align with practical application, the optimal conditions for extraction from Shengmai San are an ethanol concentration of 70%, a temperature of 60°C, and an extraction time of 3 hours. The PE and DPPH %I values obtained were 32.4% and 78.1%, respectively, with no significant deviation from the RSM model results (p>0.05).
Từ khóa (Keywords)
Shengmai San, response surface methodology, extraction, SMT, bề mặt đáp ứng, chiết xuất
Chi tiết bài viết
1. ĐẶT VẤN ĐỀ
Bài thuốc Sinh mạch tán (SMT) là một đơn thuốc thảo dược truyền thống của Trung Quốc, được trình bày trong sách “Nội ngoại thương biện hoặc luận” và bao gồm 3 loại dược liệu: nhân sâm (hoặc đảng sâm), mạch môn và ngũ vị tử [1]. SMT có tác dụng cường tim, trấn tĩnh, cải thiện vi tuần hoàn, chống đông máu và phòng ngừa trụy tim mạch do sốc nhiệt.
Nghiên cứu dược lý hiện đại của Nien-Lu Wang và cộng sự (2005) đã đánh giá bài thuốc SMT được chiết xuất từ nhân sâm, mạch môn, và ngũ vị tử, cho thấy hiệu quả trong việc ức chế sinh NO trong não và các cytokine gây viêm trong huyết thanh trên động vật thí nghiệm [2]. Gần đây, một số nghiên cứu chứng minh rằng chế phẩm từ bài thuốc có thể hỗ trợ điều trị bệnh tim, phổi [3, 4], kết hợp với các loại thuốc hóa trị liệu để tăng hiệu quả chữa bệnh và cải thiện chức năng miễn dịch của bệnh nhân ung thư [5]. SMT còn là nguồn cung cấp prebiotic và chất chống oxy hóa [6].
Dù SMT rất phổ biến trong đời sống, nhưng chưa có nhiều nghiên cứu công bố về các điều kiện chiết xuất và khảo sát hoạt tính sinh học từ SMT. Để chiết xuất các hợp chất có hoạt tính sinh học, người ta thường sử dụng phương pháp chiết bằng dung môi. Tuy nhiên, các yếu tố như: loại dung môi, nồng độ dung môi, tỷ lệ nguyên liệu/dung môi, nhiệt độ chiết xuất, thời gian chiết xuất,… có ảnh hưởng đáng kể đến hiệu suất chiết xuất [7].
Quá trình tối ưu hóa cần thực hiện nhiều thí nghiệm để lựa chọn các thông số phù hợp. Phương pháp nghiên cứu truyền thống tiếp cận từng yếu tố một, chỉ thay đổi một yếu tố tại một thời điểm trong khi giữ cố định các yếu tố khác. Tuy nhiên, phương pháp này tốn nhiều thời gian và không thể đánh giá được sự tương tác giữa các yếu tố [8].
Các nghiên cứu hiện đại sử dụng phương pháp quy hoạch thực nghiệm như thiết kế tổ hợp trung tâm (Central Composite Designs - CCD) hoặc Box-Behnken để thiết kế và lựa chọn thí nghiệm [8, 9], kết hợp với phương pháp tối ưu hóa, ví dụ như phương pháp bề mặt đáp ứng (Response Surface Methodology - RSM), nhằm đưa ra điều kiện tối ưu để đạt được mục tiêu của thí nghiệm [8, 10].
Trong nghiên cứu này, mục tiêu là thực hiện các thí nghiệm tối ưu hóa thành phần: dung môi, nhiệt độ, và thời gian chiết xuất cao từ bài thuốc SMT. Nghiên cứu sử dụng phương pháp Box-Behnken để thiết kế và khảo sát các thông số thí nghiệm, kết hợp tối ưu hóa bằng phương pháp RSM nhằm tìm ra điều kiện chiết xuất với hiệu suất cao và giá trị hoạt tính chống oxy hóa (DPPH %I) cao nhất, từ đó lựa chọn được điều kiện chiết xuất tối ưu cho bài thuốc SMT.
Không có sự khác biệt đáng kể với kết quả xác định bằng RSM (p>0.05p > 0.05p>0.05 - Bảng 4). Như vậy, kết quả thực nghiệm với nền tảng lý thuyết không có quá nhiều chênh lệch và đó là lý do lựa chọn điều kiện thí nghiệm (ethanol 70%, nhiệt độ 60°C và thời gian 3 giờ) để thực hiện tối ưu quá trình chiết cao từ bài thuốc SMT.
2. ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Đối tượng nghiên cứu
Bài thuốc SMT gồm các dược liệu chính: Nhân sâm (Rhizoma et Radix Ginseng), Mạch Môn (Radix Ophiopogonis japonici), Ngũ vị tử (Fructus Schisandrae chinensis), Cát cánh (Radix Platycodi grandiflorum), Cam thảo (Radix et Rhizoma Glycyrrhizae) được nhập từ Công ty cổ phần dược liệu Indochina với chứng nhận chất lượng kèm theo. Dược liệu được sấy khô trong tủ sấy ở 55°C, sau đó đem nghiền thành bột và bảo quản ở -20°C cho tới khi sử dụng.
2.2. Phương pháp bố trí thí nghiệm 2.2.1. Khảo sát đơn yếu tố
Mục tiêu của các thí nghiệm là chọn điều kiện thích hợp (dung môi, nhiệt độ, thời gian) để chiết xuất cao từ bài thuốc SMT. Bước đầu của thí nghiệm là nghiên cứu ảnh hưởng của dung môi đến hiệu suất chiết cao và hoạt tính chống oxy hóa (DPPH %I). Quá trình chiết xuất được thực hiện bằng cách sử dụng 2 g bột SMT và 60 mL dung môi có nồng độ thay đổi (0-90%). Bình chiết được đặt ở nhiệt độ từ 60°C đến 70°C trong 2 giờ, với tốc độ khuấy 150 vòng/phút. Cao chiết sau đó được quay cô để thu dịch chiết.
Bước tiếp theo là khảo sát các yếu tố nhiệt độ chiết và thời gian chiết, sử dụng cao chiết từ bài thuốc SMT. Mỗi điều kiện khảo sát được thực hiện lặp lại 3 lần để đánh giá sự khác biệt thống kê. Chiết xuất thực hiện với các khoảng thời gian từ 0,5 đến 4 giờ tại 60°C và 70°C để xác định điều kiện tối ưu.
2.2.2. Phương pháp tối ưu hóa quy trình chiết xuất
Tối ưu hóa điều kiện chiết xuất từ bài thuốc SMT được thực hiện bằng phương pháp RSM. Ba yếu tố được khảo sát bao gồm: dung môi (EtOH, %), nhiệt độ chiết (°C), và thời gian chiết (h). Các mức của ba yếu tố này được bố trí thực nghiệm theo phương pháp Box-Behnken, nhằm tối ưu hóa quá trình và tìm ra điều kiện tốt nhất để chiết xuất bài thuốc.
Hàm hồi quy được mô tả để tối ưu hóa giá trị hiệu suất chiết xuất và hoạt tính chống oxy hóa (DPPH %I) là một hàm của các biến độc lập như sau:
Trong đó:
- Y: Là các yếu tố đầu ra (hiệu suất chiết cao (PE) và phần trăm ức chế gốc tự do DPPH %I).
- Xi, Xj: Là các yếu tố đầu vào (nồng độ EtOH, nhiệt độ, thời gian).
- β0, βi, βii, βij: Là các hệ số hồi quy tương ứng.
Phương pháp phân tích phương sai (ANOVA) được áp dụng để đánh giá sự phù hợp của mô hình và tính hiệu quả của các yếu tố. Giá trị ý nghĩa thống kê được coi là có ý nghĩa với độ tin cậy 95% (p < 0,05).
2.2.3. Phương pháp xác định hiệu suất chiết cao
Dịch sau chiết tại các thí nghiệm được sấy khô đến khối lượng không đổi, cần xác định hàm lượng chất thu được. Hiệu suất chiết cao được tính như sau:
Hiệu suất chiết cao
Trong đó:
- m: Là khối lượng chất thu được (g).
- M: Là khối lượng dược liệu đem chiết (g).
2.2.4. Phương pháp đánh giá hoạt tính chống gốc tự do DPPH
Mẫu thử và DPPH được pha loãng trong DMSO với nồng độ 30 µg/mL. 20 µL mẫu thử được ủ với 200 µL dung dịch DPPH, ủ tối ở 37°C trong 20 phút và đo trên máy ELISA ở bước sóng 517 nm. Chất chống oxy hóa (ascorbic acid) được dùng để kiểm soát và đánh giá hoạt tính chống tự do trong dung dịch. Các phép thử được lặp lại 3 lần.
Phần trăm ức chế gốc tự do (DPPH %I) được tính theo công thức sau:
Trong đó:
- ODa: Mật độ quang trung bình của mẫu thử ở nồng độ 30 µg/mL.
- ODo: Mật độ quang trung bình của mẫu đối chứng (không có mẫu thử, chỉ có DPPH, ở nồng độ tương tự).
Nồng độ gây ức chế 50% (IC50) được tính dựa trên đường chuẩn với %I của các nồng độ khác nhau từ thí nghiệm.
2.2.5. Phương pháp xử lý số liệu
Mô hình Box-Behnken và phương pháp bề mặt đáp ứng RSM được triển khai bằng phần mềm Design Expert 13 (Stat-Ease, Hoa Kỳ). Các yếu tố đầu vào như nồng độ EtOH (%), nhiệt độ chiết (°C), và thời gian chiết (h) được thực hiện với các mức cụ thể. Thiết kế thực nghiệm Box-Behnken bao gồm 17 thí nghiệm được bố trí trong các tổ hợp giữa các yếu tố đầu vào.
Kết quả được tính toán thống kê bằng phần mềm Microsoft Excel (Microsoft, Hoa Kỳ). Sử dụng phần mềm SPSS 20 để thực hiện phương pháp kiểm định giá trị trung bình One-Sample T Test để kiểm tra kết quả thí nghiệm và kết quả tối ưu bằng RSM với p < 0,05 có ý nghĩa thống kê.
3. KẾT QUẢ VÀ BÀN LUẬN
3.1. Kết quả khảo sát đơn yếu tố
Tác động của nồng độ ethanol khác nhau (0%, 30%, 50%, 70%, 90%) đến PE và DPPH %I được tiến hành ở 70°C trong 2 giờ. Kết quả cho thấy, giá trị PE và DPPH %I đều tăng theo nồng độ ethanol (Hình 1a). Khi tăng giá trị %EtOH từ 0 đến 70%, PE tăng nhanh từ 10,3% lên 31,4%, tương tự, giá trị DPPH %I cũng tăng từ 45,3% lên 75,6%
Tăng từ 45,3-75,6%. Khi giá trị EtOH là 90% cả PE và DPPH %I đều có xu hướng tăng nhẹ, nhưng không đáng kể. Xem xét tác động nồng độ trong thiết kế khá phức tạp, do vậy cần khảo sát trên khoảng rộng từ 0-90% cho RSM.
Khi cố định nồng độ ethanol và nhiệt độ, chiết xuất trong khoảng thời gian khác nhau (0,5h; 1h; 2h; 3h; 4h) cho các kết quả về hiệu suất chiết cao và DPPH %I khác biệt. Kết quả Hình 1b cho thấy, thời gian chiết càng lâu thì khối lượng cao chiết được càng lớn, giá trị PE tăng nhanh trong khoảng từ 0,5-3 giờ đầu (từ 12,8% lên 34,8%) và chỉ tăng nhẹ từ 3 giờ đến 4 giờ tiếp theo từ 34,8% lên 35,4%. Trong khi đó, giá trị DPPH %I chỉ tăng trong 3 giờ đầu và giảm khi tăng thời gian chiết từ 3 giờ lên 4 giờ.
Rõ ràng, thời gian chiết càng lâu sẽ thu được khối lượng cao chiết càng lớn, tuy nhiên, một số hoạt chất có thể bị phân hủy dưới tác động của nhiệt trong thời gian dài [11]. Do vậy, để đánh giá tối ưu thời gian chiết xuất đồng thời với cả giá trị PE và DPPH %I, tiến hành khảo sát trong khoảng 0,5-4 giờ cho RSM.
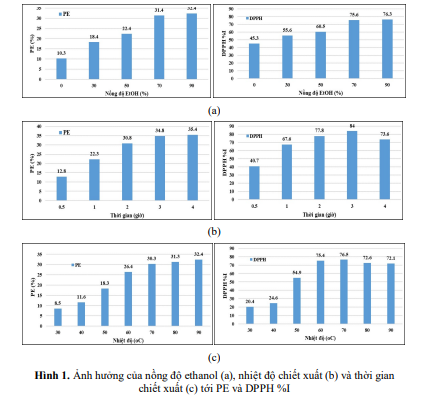
Hình 1. Ảnh hưởng của nồng độ ethanol (a), nhiệt độ chiết xuất (b) và thời gian chiết xuất (c) tới PE và DPPH %I
Tác động của nhiệt độ đến giá trị PE và DPPH %I được trình bày tại Hình 1c. Theo đó, hiệu suất chiết cao tăng nhanh khi tăng nhiệt độ từ 30°C lên 70°C, khi tăng nhiệt độ trên 70°C, giá trị PE có tăng nhưng không đáng kể (từ 30,3% đến 32,4%). Tuy nhiên nhiệt độ cao, hoạt chất được thu hồi thấp hơn bởi sự phân hủy sắc tố tại nhiệt độ không thích hợp [12, 13]. Giá trị DPPH %I giảm khi nhiệt độ vượt quá 70°C. Ngoài ra, dung môi là ethanol có điểm sôi 80°C, nên ở khoảng nhiệt độ chiết 80-90°C, sự bay hơi của dung môi là rất mạnh dẫn tới thay đổi đáng kể về thể tích dung môi và làm giảm hiệu suất chiết. Do vậy, chọn nhiệt độ khảo sát trong khoảng 30-80°C cho RSM.
3.2. Tối ưu hóa quy trình chiết xuất bằng RSM
Trên cơ sở khảo sát các yếu tố ảnh hưởng đến hiệu suất chiết cao và DPPH %I, có thể thấy, nồng độ ethanol, nhiệt độ và thời gian là những yếu tố có ảnh hưởng đến quá trình chiết xuất SMT. Phương pháp bề mặt đáp ứng theo thiết kế thí nghiệm Box-Behnken với 17 thí nghiệm, kết quả thí nghiệm được trình bày tại Bảng 1.
Bảng 1. Các thí nghiệm được thiết kế bằng phương pháp Box-Behnken và các giá trị đầu ra tương ứng
| STT | %EtOH | Nhiệt độ (°C) | Thời gian (h) | PE (%) | DPPH %I (30 µg/mL) |
|---|---|---|---|---|---|
| 1 | 50 | 60 | 2.25 | 30.15 | 40.10 |
| 2 | 70 | 50 | 2.25 | 30.55 | 51.22 |
| 3 | 70 | 70 | 2.25 | 32.62 | 78.43 |
| 4 | 50 | 80 | 2.25 | 30.02 | 44.75 |
| 5 | 70 | 60 | 3.00 | 32.46 | 78.36 |
| 6 | 90 | 60 | 2.25 | 32.39 | 72.96 |
| 7 | 70 | 60 | 1.50 | 30.35 | 72.48 |
| 8 | 30 | 60 | 2.25 | 15.89 | 22.60 |
| 9 | 90 | 70 | 3.00 | 32.52 | 77.15 |
| 10 | 50 | 50 | 3.00 | 30.35 | 39.65 |
| 11 | 90 | 50 | 2.25 | 32.02 | 59.48 |
| 12 | 70 | 50 | 3.00 | 32.02 | 61.43 |
| 13 | 70 | 50 | 1.50 | 31.15 | 60.76 |
| 14 | 70 | 80 | 3.00 | 30.35 | 76.15 |
| 15 | 70 | 80 | 1.50 | 30.35 | 75.62 |
| 16 | 90 | 70 | 1.50 | 30.35 | 77.05 |
| 17 | 50 | 70 | 2.25 | 30.15 | 50.24 |
Dựa vào số liệu thu thập tại Bảng 1, phần mềm Design Expert 13 đã đưa ra hai phương trình hồi quy chứng minh mối quan hệ thực nghiệm giữa các giá trị đầu ra (PE và DPPH %I) và các thông số điều kiện bao gồm nồng độ ethanol (A), nhiệt độ (B) và thời gian (C) như sau:
(4)
(5)
Trong đó:
- A: Là giá trị nồng độ ethanol (%).
- B: Là giá trị nhiệt độ (°C).
- C: Là thời gian chiết (giờ).
Các phương trình này chỉ ra rằng mô hình bề mặt đáp ứng là đa thức bậc hai (4, 5). Tuy nhiên, kiểm phát việc phù hợp của mô hình được kiểm tra kỹ lưỡng qua các chỉ số. Phương pháp kiểm tra xem mô hình có phù hợp hay không. Kết quả kiểm định ANOVA tại Bảng 2 cho thấy, phương trình hồi quy PE và DPPH %I đạt sự tương quan khá tốt với phản tích phương sai có ý nghĩa thống kê (p < 0.05).
Bảng 2. Kết quả phân tích phương sai (ANOVA) của mô hình hồi quy được lựa chọn với biến đầu ra PE và DPPH %I
| Phân tích ANOVA PE | Phân tích ANOVA DPPH %I | ||
|---|---|---|---|
| Yếu tố | Kiểm định F | Bình phương trung bình | p |
| Mô hình | 96.35 | 2751.56 | < 0.0001 |
| A-EtOH | 44.55 | 1272.61 | < 0.0001 |
| B-Nhiệt độ | 55.23 | 1582.47 | < 0.0001 |
| C-Thời gian | 122.12 | 3024.12 | < 0.0001 |
| AB | 3.47 | 97.49 | 0.0212 |
Phân tích ANOVA PE | Phân tích ANOVA DPPH %I |
| ||||
|---|---|---|---|---|---|---|
Yếu tố | Tổng bình phương | Kiểm định F | p | Tổng bình phương | Kiểm định F | p |
| AC | 7.02 | 3.48 | 0.1402 | 4.62 | 0.8055 | 0.3993 |
| BC | 2.69 | 1.34 | 0.2859 | 3.46 | 0.3220 | 0.2801 |
| A² | 63.4 | 31.12 | 0.0021 | 57.63 | 18.43 | 0.0003 |
| B² | 38.28 | 19.14 | 0.0031 | 110.91 | 36.54 | 0.0001 |
| C² | 263.63 | 131.30 | 0.0005 | 263.63 | 113.41 | 0.0008 |
| Lack of Fit* | 11.23 | 5.21 | 0.0784 | 14.23 | 4.08 | 0.0818 |
| R² | 0.96 | Adj-R² | 0.97 | |||
* Lack of Fit: sự thiếu phù hợp.
Kết quả phân tích cho thấy, các biến A-EtOH, B-Nhiệt độ, C-Thời gian, A², B², C² có tác động đáng kể đến giá trị PE và DPPH %I (p < 0.05). Ngoài ra biến AB có giá trị p > 0.05 trong phương trình tuyến tính với giá trị DPPH %I.
Dựa trên phân tích ANOVA (Bảng 2), loại bỏ các biến có tác động không đáng kể đến giá trị PE và DPPH %I (p > 0.05), sau đó có thể viết lại phương trình hồi quy tuyến tính (4) và (5) như sau:
(6)
(7)
Phân tích các đồ họa mô phỏng 3D (Hình 2), ảnh hưởng của nồng độ ethanol, nhiệt độ và thời gian đến hiệu suất chiết PE và giá trị DPPH %I được thể hiện rõ. Giá trị DPPH %I tăng mạnh khi tăng nồng độ ethanol từ 0-70% và giảm khi nồng độ > 70% (Hình 2a).
Nhiệt độ chiết xuất cũng ảnh hưởng đáng kể khi tăng nhiệt độ từ 30°C đến 60°C (Hình 2b). Tuy nhiên, sau thời gian 3-4 giờ, giá trị PE có xu hướng giảm nhẹ và không còn tăng đáng kể (Hình 2c).
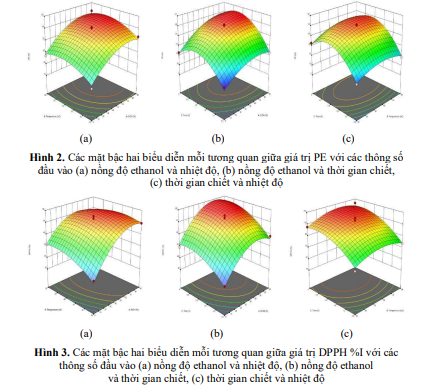
Ảnh hưởng của nồng độ ethanol, nhiệt độ chiết xuất, thời gian và sự tương tác của chúng đối với giá trị DPPH %I được trình bày thông qua biểu đồ bề mặt đáp ứng 3D tại Hình 3. Theo đó, nồng độ ethanol có ảnh hưởng đáng kể đến giá trị DPPH %I (p < 0.0001 - Bảng 2). Giá trị DPPH %I tăng khi nồng độ ethanol từ 0-70% và có xu hướng giảm khi nồng độ >70% (Hình 3a; Hình 3b).
Nhiệt độ có ảnh hưởng đến giá trị DPPH %I (p < 0.05 - Bảng 2). Giá trị DPPH %I tăng khi tăng nhiệt độ (từ 30-60°C) và nồng độ ethanol (từ 0-70%), khi nhiệt độ >60°C giá trị DPPH %I giảm (Hình 3a).
Hiệu ứng giữa nồng độ ethanol và thời gian chiết xuất, nhiệt độ và thời gian chiết xuất có sự tương đồng. Trong khoảng thời gian từ 0,5-3h chiết xuất, khi tăng nhiệt độ hoặc nồng độ ethanol, giá trị DPPH %I cũng tăng; tuy nhiên kéo dài thời gian chiết xuất >3h, giá trị DPPH %I có xu hướng giảm (Hình 3b và Hình 3c). Thời gian chiết xuất có ảnh hưởng đáng kể đến giá trị DPPH %I (p < 0.0001 - Bảng 2).
3.3. Lựa chọn điều kiện chiết xuất tối ưu để tạo cao chiết
Kết quả tính toán lý thuyết bằng phần mềm đưa ra được 100 công thức. Sau khi đánh giá mức độ ưu tiên xác định được 5 công thức có số điểm cao nhất (Bảng 3). Trong đó, công thức số 20 có giá trị PE lớn nhất (hiệu suất chiết cao) đồng thời với giá trị DPPH %I tối ưu đồng thời.
Như vậy, xác định được điều kiện tối ưu cho quá trình chiết xuất bài thuốc SMT đã đạt đồng thời giá trị PE và DPPH %I phù hợp lần lượt là nồng độ ethanol 67%; nhiệt độ 62,2°C và thời gian 2,9 giờ. Khi đó, giá trị PE và DPPH %I tối ưu lần lượt là 32,6% và 78,4% (Hình 4). Điều kiện này phù hợp với điều kiện kiểm nghiệm lựa chọn điều kiện chiết xuất SMT là ethanol 70%, nhiệt độ 60°C và thời gian 3 giờ.
Bảng 3. Giá trị và mức độ ưu tiên của các công thức được xác định bằng RSM
| Công thức | Điều kiện thí nghiệm | Giá trị PE | Giá trị DPPH | Mức độ ưu tiên | ||
|---|---|---|---|---|---|---|
| EtOH (%) | Nhiệt độ (°C) | Thời gian (h) | PE | DPPH | Tổng | |
| 49 | 65.58 | 65.82 | 3.2 | 31.3 | 78.3 | 10 |
| 66 | 61.01 | 70.00 | 3.0 | 32.6 | 78.2 | 9 |
| 69 | 70.00 | 65.58 | 3.0 | 32.5 | 78.1 | 9 |
| 80 | 65.00 | 62.60 | 3.2 | 32.2 | 78.4 | 10 |
| 20 | 67.00 | 60.00 | 3.0 | 32.6 | 78.4 | 11 |
Hình 4. Điều kiện chiết xuất tối ưu giá trị PE và DPPH %I xác định bằng RSM

Thí nghiệm chiết SMT trong điều kiện tối ưu đã thiết lập (ethanol 70%; nhiệt độ 60°C và thời gian 3 giờ) được lặp lại 10 lần và đạt được các giá trị kiểm nghiệm bằng phương pháp One-Sample T Test với giá trị PE là 32,4% và DPPH %I là 78,1%. Kết quả chiết xuất đạt mức tối ưu, đảm bảo hiệu quả cả về hiệu suất chiết và hoạt tính chống oxy hóa.
Không có sự khác biệt đáng kể với kết quả xác định bằng RSM (p > 0.05 - Bảng 4). Như vậy, kết quả thực nghiệm với tính toán lý thuyết không có quá nhiều chênh lệch và có thể lấy điều kiện thí nghiệm (ethanol 70%; nhiệt độ 60°C và thời gian 3 giờ) để thực hiện tối ưu quá trình chiết cao từ bài thuốc SMT.
Bảng 4. Kết quả phân tích One-Sample T Test
| Chỉ số | Số mẫu | Giá trị trung bình* | Giá trị so sánh** | Sig.*** |
|---|---|---|---|---|
| PE | 20 | 32,4 ± 0,05 | 32,583 | 0,078 |
| DPPH %I | 20 | 78,1 ± 0,06 | 78,366 | 0,109 |
* Giá trị trung bình là giá trị trung bình của các kết quả thực nghiệm với điều kiện chiết xuất SMT là ethanol 70%; nhiệt độ 60°C và thời gian 3 giờ.
** Giá trị so sánh là giá trị xác định bằng phương pháp RSM.
*** Sig.: Giá trị p < 0,05 có ý nghĩa thống kê.
4. KẾT LUẬN
Trong nghiên cứu này, phương pháp bề mặt đáp ứng được sử dụng để tối ưu điều kiện chiết cao từ bài thuốc SMT. Kết quả đã chứng minh rằng nồng độ ethanol, nhiệt độ và thời gian là những yếu tố chính ảnh hưởng lớn nhất đến hiệu suất chiết cao và hoạt tính chống oxy hóa (DPPH %I).
Kết quả thực nghiệm phù hợp với dự đoán lý thuyết và các kết quả thống kê đều có ý nghĩa thống kê, đồng thời không có sự lệch lớn. Điều kiện chiết xuất tối ưu được xác định là ethanol 70%; nhiệt độ 60°C và thời gian 3 giờ. Kết quả này là cơ sở để phát triển sản xuất cao SMT ở quy mô lớn hơn.
Tài liệu tham khảo
2. Wang N. L. O., Chang C. K., Liou Y. L., Lin C. L., Lin M. T., Shengmai San, a Chinese herbal medicine protects against rat heat stroke by reducing inflammatory cytokines and nitric oxide formation, Journal of Pharmacological Sciences, 2005, 98(1):1-7. DOI: 10.1254/jphs.fp0050018
3. Xian S., Yang X., Lee J., Jiang Z., Ye X., Luo L., A randomized, double-blind, multicenter, placebo-controlled clinical study on the efficacy and safety of Shenmai injection in patients with chronic heart failure, J Ethnopharmacol, 2016, 186:136-142. DOI: 10.1016/j.jep.2016.03.066
4. Kim M. C., Kim S. J., Choi I. Y., Ki J. Y., Kim D. S., Jeon Y. D., Bae G. E., Li J. S., Wang H. F., Li S. Y., SHENMAI injection for Chronic pulmonary heart disease: A systematic review and meta-analysis, J. Altern. Complement. Med., 2011, 17:579-587. DOI: 10.1089/acm.2010.0354
5. Xiaohui F., Yi W., Yiyu C., LC/MS fingerprinting of Shenmai injection: a novel approach to quality control of herbal medicines, J. Pharm. Biomed. Anal., 2006, 40:591-597. DOI: 10.1016/j.jpba.2005.10.036
6. Kang J., Zhao J., He L. F., Li L. X., Zhu Z. K., Tian M. L., Extraction, characterization and anti-oxidant activity of polysaccharide from red Panax ginseng and Ophiopogon japonicus waste, Front. Nutr., 2023, 10:1183096. DOI: 10.3389/fnut.2023.1183096
7. Omwamba M., Hu Q., Antioxidant capacity and antioxidative compounds in barley (Hordeum vulgare L.) grain optimized using response surface methodology in hot air roasting, Eur. Food Res. Technol., 2009, 229:907-914. DOI: 10.1007/s00217-009-1128-7
8. Gong Y., Hou Z., Gao Y., Xue Y., Liu X., Liu G., Optimization of extraction parameters of bioactive components from defatted marigold (Tagetes erecta L.) residue using response surface methodology, Food and Bioproducts Processing, 2012, 90(1):9-16. DOI:10.1016/j.fbp.2010.12.004
9. Jeganathan P. M., Venkatachalam S., Karichappan T., Ramasamy S., Model development and process optimization for solvent extraction of polyphenols from red grapes using Box-Behnken Design, Preparative Biochemistry & Biotechnology, 2014, 44(1):56-67. DOI: 10.1080/10826068.2013.791629
10. Nguyen Thi Ai Lan, Tran Chi Linh, Optimization of the extraction process of polyphenols and flavonoids from breadfruit leaves (Artocarpus altilis), TNU Journal of Science and Technology, 2022, 227(10):47-55
11. Chirinos R., Rogez H., Campos D., Pedreschi R., Larondelle Y., Optimization of extraction conditions of antioxidant phenolic compounds from mashua (Tropaeolum tuberosum Ruíz & Pavón) tubers, Sep. Purif. Technol., 2007, 55:217-225. DOI:10.1016/j.seppur.2006.12.005
12. Xu G., Ye X., Chen J., Liu D., Effect of heat treatment on the phenolic compounds and antioxidant capacity of citrus peel extract, Journal of Agricultural and Food Chemistry, 2017, 55(2):330-335. DOI: 10.1021/jf062517l
13. Zhang Q. W., Lin L. G., Ye W. C., Techniques for extraction and isolation of natural products: a comprehensive review, Chinese Medicine, 2018, 13(1):20. DOI: 10.1186/s13020-018-0177-x