NGHIÊN CỨU ỨNG DỤNG VI KHUẨN ĐỂ CẢI THIỆN CHẤT LƯỢNG ĐẤT CANH TÁC NÔNG NGHIỆP
Viện Vi sinh vật và Công nghệ sinh học, Đại học Quốc gia Hà Nội
Số 144 Xuân Thuỷ, Cầu Giấy, Hà Nội
Số điện thoại: 0972523466; Email: dthangimbt@gmail.com
Nội dung chính của bài viết
Tóm tắt (Abstract)
APPLICATION OF BENEFICIAL BACTERIA TO IMPROVE AGRICULTURAL SOIL QUALITY
Two bacterial strains, VK7 and SDT2.3, possess multiple biological activities beneficial to plants, including IAA production, siderophore synthesis, nitrogen fixation, EPS production, and phosphate solubilization. These strains are expected to have potential applications for improving agricultural soil quality. Based on comparisons of 16S rDNA sequences and rpoB gene sequences, these bacterial strains were identified as Bacillus velezensis VK7 and Ensifer sesbaniae SDT2.3.
A bioformulation containing live cells of two strains VK7 and SDT2.3 was tested on degraded soil from a tea-cultivated farm with tomato plants under greenhouse conditions. After one crop season (4 months), soil properties improved significantly: total organic carbon increased by 16.51% and sand content in the soil mechanical composition rose by 120.11%. Enhanced soil quality was further evidenced by a 15.70% increase in green biomass (stem and leaf weight) compared to untreated control. Notably, the combined application of both bacterial strains reduced NPK fertilizer usage by 10% compared to conventional methods, with no adverse effects on plant growth or yield.
Từ khóa (Keywords)
Bacillus velezensis, Ensifer sesbaniae, Chemical fertilizer reduction, soil quality, soil fertility, giảm sử dụng phân bón hóa học, chất lượng của đất, độ phì nhiêu của đất
Chi tiết bài viết
1. ĐẶT VẤN ĐỀ
Đất là môi trường sống cho hàng triệu vi sinh vật (VSV), trong đó >85% là các loài có lợi cho cây trồng. Đất chất lượng tốt có tỷ lệ trung bình 93% chất khoáng và 7% chất hữu cơ sinh học, bao gồm mùn (85%), rễ (10%) và hệ sinh vật đất (5%) [1]. Hệ sinh vật đất bao gồm VSV đất (khoảng 80%) và động vật đất như giun tròn, tuyến trùng (khoảng 20%). Trong VSV đất, nấm và tảo chiếm 50%, nửa còn lại là vi khuẩn và xạ khuẩn. VSV đất là yếu tố chính quyết định sự cân bằng sinh thái trong đất thông qua vai trò trong các chu trình chuyển hóa vật chất trong tự nhiên. Đất có hệ VSV khỏe mạnh sẽ có các đặc tính lý hóa cân bằng, đảm bảo các điều kiện thích hợp cho sản xuất nông nghiệp [2]. Ngoài ra, hệ VSV đất còn có mối tương tác đặc biệt đối với cây trồng, nhiều loài sống cộng sinh/hội sinh với thực vật và hỗ trợ cây trồng bằng nhiều phương thức khác nhau [3].
Dưới áp lực diện tích canh tác ngày càng bị thu hẹp trong khi nhu cầu tăng năng suất cây trồng, nhiều loại phân bón hóa học và các hóa chất bảo vệ thực vật đang được sử dụng quá mức trong canh tác nông nghiệp. Cùng với tình trạng khai thác quá mức khiến đất bị bạc màu nghiêm trọng và khó có khả năng tự phục hồi. Sản xuất nông nghiệp theo hướng phát triển bền vững sử dụng các chế phẩm sinh học từ VSV là cách tiếp cận được nhiều quốc gia trên thế giới quan tâm [4]. Các sản phẩm từ VSV như phân bón vi sinh chứa các VSV có ích, giúp tăng cường độ phì nhiêu của đất và hỗ trợ sinh trưởng của cây trồng thông qua (i) tăng cường dinh dưỡng nhờ cố định nitơ, hòa tan phosphat/kali/kẽm; (ii) tăng độ phì nhiêu của đất nhờ phân hủy các chất hữu cơ; (iii) kích thích sinh trưởng nhờ sản sinh các hormon thực vật và (iv) đối kháng các tác nhân gây bệnh thực vật [5]. Các minh chứng thực nghiệm cho thấy bổ sung vi sinh vật vào đất canh tác là một lợi thế so với sử dụng hóa chất trong nông nghiệp nhờ vai trò nền tảng của VSV như là nguồn dinh dưỡng tái tạo thân thiện với môi trường và kích hoạt các quá trình sinh học trong đất, từ đó khôi phục độ phì nhiêu của đất [6].
Theo thống kê, diện tích đất tự nhiên của Việt Nam là 33 triệu ha, trong đó 26,1 triệu ha được sử dụng cho nông nghiệp (bao gồm trồng trọt, chăn nuôi và thủy sản) [7]. Theo báo cáo của Tổng cục quản lý đất đai (2020), Việt Nam hiện nay có tới 11,838 triệu ha đất nông nghiệp bị thoái hóa, trong đó 1,2 triệu ha bị thoái hóa nặng, 3,787 triệu ha bị thoái hóa ở mức trung bình, và một phần lớn 6,844 triệu ha bị thoái hóa nhẹ. Sử dụng VSV hữu ích trong canh tác nông nghiệp là cách tiếp cận an toàn để từng bước kiểm soát tình trạng thoái hóa đất canh tác hiện nay. Việc sử dụng phân bón vi sinh trước hết làm tăng tính đa dạng và duy trì sự cân bằng của hệ VSV đất, nhờ đó cải thiện hiệu quả môi trường đất. Hệ VSV đất được làm giàu không chỉ thúc đẩy cây hấp thụ và sử dụng hiệu quả các chất dinh dưỡng N, P, K, và tăng năng suất, mà còn giúp cây tăng sức đề kháng toàn thân, ngăn chặn hiệu quả sự xâm nhập của mầm bệnh [8].
Trong nghiên cứu này, hai chủng vi khuẩn bản địa là Bacillus velezensis VK7 và Ensifer sesbaniae SDT2.3 được tuyển chọn để ứng dụng trong mục đích cải thiện chất lượng đất canh tác bị thoái hóa nhờ sở hữu các đặc tính sinh học quý như cố định nitơ, sinh IAA, sinh EPS và siderophore, hòa tan phosphat. Hiệu quả cải tạo đất của các chủng này được minh chứng thông qua thí nghiệm trồng cây trên đất canh tác bị thoái hóa trong điều kiện nhà lưới.
2. ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Đối tượng
Chủng vi khuẩn VK7 phân lập từ đất vườn và chủng SDT2.3 từ nốt sần rễ đậu tương được lưu giữ tại Trung tâm Nguồn gen Vi sinh vật Quốc gia (Vietnam Type Culture Collection, viết tắt là VTCC).
Cây cà chua Ansal (Ấn Độ) Lycopercicum esculentum Mill là giống chịu nhiệt, ở độ tuổi 5-6 tuần, cao 10-12 cm, có 5-6 lá thật được sử dụng trong thí nghiệm.
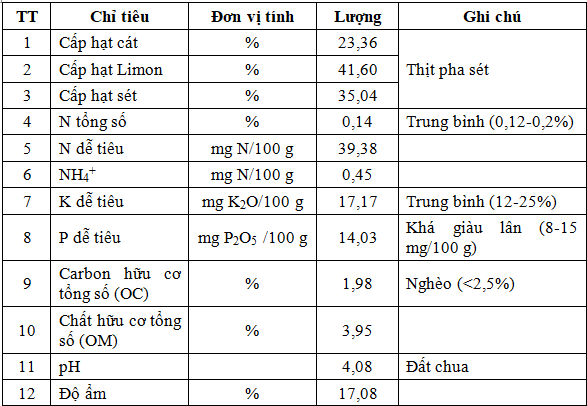
Đất bị thoái hóa được lấy tại Nông trường chè Long Phú, xã Hòa Thạch, huyện Quốc Oai, Hà Nội. Theo kết quả điều tra bằng phương pháp phỏng vấn, đất được trồng chè sử dụng phân bón hóa học trong thời gian dài. Trong những năm gần đây đất trở nên khô, chai cứng, cây phát triển kém và năng suất thấp. Các chỉ tiêu tính chất của đất được phân tích tại phòng thí nghiệm Soiltech (Tòa HT1, Khu đô thị ĐHQGHN tại Hoà Lạc, Thạch Thất, Hà Nội) (Bảng 1).
Bảng 1. Tính chất lý hóa của đất thu thập ở nông trường chè Long Phú, xã Hòa Thạch, huyện Quốc Oai, Hà Nội
2.2. Phương pháp
2.2.1. Đánh giá các hoạt tính sinh học của vi khuẩn
Cố định nitơ: Hoạt tính cố định nitơ được định lượng thông qua phương pháp khử acetylen [9, 10]. Vi khuẩn được nuôi trong môi trường TSB 1/5 (HiMedia, Ấn Độ) trong 24 giờ tại 28-30°C, lắc 120 vòng/min. Sau đó cấy chuyển dịch nuôi (tỷ lệ 10% thể tích) vào bình serum chứa môi trường Mannit dịch thể không có nguồn nitơ (mannitol 10 g, KH2PO4 1 g, MgSO4.7H2O 0,5 g, NaCl 0,5 g, CaCl2.2H2O 0,05 g, 1 mL dung dịch vi lượng, nước cất 1 L, pH 7,2) [11] rồi đậy kín bình bằng nút cao su và kẹp vòng nhôm. Hút 3 mL khí trong bình và thay bằng 3 mL khí acetylen (ngoại trừ đối chứng âm). Các bình được tiếp tục nuôi trong 24 h ở nhiệt độ 28-30°C, lắc 120 vòng/min. Khí ethylen tạo ra trong các bình được xác định bằng sắc ký khí (Agilent 7890A, USA) sử dụng detector FID với chế độ vận hành như sau: nhiệt độ detector 250°C, nhiệt độ lò 60°C, khí mang là helium ở tốc độ dòng 30 mL/min. Hàm lượng khí ethylen được tính toán dựa trên đường chuẩn xây dựng cho khí ethylen tiêu chuẩn (Messer Việt Nam).
Sinh phytohormon Indol-3-acetic acid (IAA): Vi khuẩn được nuôi trong môi trường TSB 1/5 (HiMedia, Ấn Độ) bổ sung L-tryptophan (1 g/L) tại 28-30°C, lắc 120 vòng/min trong 7 ngày. Dịch nuôi được ly tâm 6000 vòng/min trong 20 min để loại tế bào. Dịch canh trường sau đó được trộn với thuốc thử Salkowski (98 mL perchloric acid HClO4 35%, 2 mL FeCl3 0,5 M) theo tỷ lệ 2:1 (v/v) và giữ trong điều kiện tối trong 30 phút. Đo độ hấp thụ ở bước sóng 530 nm và tính toán lượng IAA dựa trên đường chuẩn có nồng độ trong khoảng 10 - 100 μg/mL [12].
Hòa tan phosphat: Vi khuẩn được nuôi trong môi trường dịch thể PSM (sorbitol 10 g, Ca3(PO4)2 5 g, MgCl2.6H2O 5 g, MgSO4.7H2O 0,25 g, KCl 0,2 g, (NH4)2SO4 0,1 g, nước cất 1 L, pH 7) tại 28-30°C, lắc 180 vòng/min trong 48h. Hoạt tính hòa tan phosphat được xác định thông qua định lượng PO43− qua phản ứng tạo phức hợp antimon-phospho-molybdat và đo độ hấp thụ ở bước sóng 882 nm [13]. Đường chuẩn nồng độ PO43− được xây dựng sử dụng dung dịch KH2PO4 trong khoảng 0 - 600 µg/L.
Sinh exopolysaccharide ngoại bào (EPS): Vi khuẩn được nuôi trong môi trường dịch thể YEM (cao nấm men 0,5 g, inositol 4 g, nước cất 1 L, pH 7) tại 28-30°C, lắc 160 vòng/min trong 72 h. EPS được tủa bằng ethanol lạnh theo tỷ lệ ethanol:dịch nuôi = 3:1 (v/v). Phần tủa sau ly tâm được sấy ở 60oC trong 48 h và cân đến khối lượng không đổi [14].
Sinh siderophore: Hoạt tính sinh siderophore được đánh giá theo phương pháp của Lakshmanan et al. (2015) [15], tóm tắt như sau: Hòa tan 60,5 mg chrome azurol S (Sigma) trong 50 mL nước cất, sau đó trộn với 10 mL dung dịch sắt (III) (FeCl3.6H2O 1 mM, HCl 10 mM). Hỗn hợp này được rót từ từ vào dung dịch hexadecyltrimethylammoni bromua (CTAB) 5 M, trộn đều rồi khử trùng. Bổ sung dung dịch vào môi trường TSA (Himedia) đã vô trùng với tỷ lệ 10% thể tích, trộn đều rồi chia vào các đĩa petri. Vi khuẩn được cấy trên đĩa và nuôi ở 28-30°C trong 3 ngày. Hoạt tính sinh siderophore được nhận biết thông qua thay đổi màu sắc môi trường từ xanh dương sang vàng cam.
2.2.2. Định danh vi khuẩn
DNA hệ gen của chủng vi khuẩn được tách bằng EZNA Bacterial DNA kit (Omega, Mỹ). Trình tự gen 16S rDNA được khuyếch đại bằng cặp mồi 27F (5'-AGAGTTTGATCCTGGCTCAG-3') và 1492R (5'-GTTACCTTGTTACGACTT-3') với chương trình PCR sau: 94°C 3 min, (94°C 30 s, 55°C 45 s, 72°C 1,5 min) ´ 35 chu kỳ, 72°C 7 min, kết thúc 4°C [16]. Cặp mồi sử dụng để khuyếch đại các vùng bảo tồn của gen rpoB là rpoB2292f (5'-GACGTGGGATGGCTACAACT-3') và rpoB-3354r (5'-ATTGTCGCCTTTAACGATGG-3') với chương trình PCR sau: 94°C 5 min, (94°C 30 s, 55°C 30 s, 72°C 1 min) x 30 chu kỳ, 72°C 7 min, kết thúc 4°C [17]. Sản phẩm PCR sau đó được tinh sạch bằng PCR purification Kit (Bioneer, Hàn Quốc) rồi tiến hành phản ứng đọc trình tự với ABI Prism BigDye Terminator cycle sequencing kit và đọc trình tự trên máy tự động 3110 Avant Appied Biosystems. Trình tự sau đó được phân tích, so sánh với trình tự các gen 16S rDNA và rpoB của các loài vi khuẩn có liên quan hiện đã công bố trên ngân hàng dữ liệu EZTAXON và GenBank sử dụng công cụ BLAST Search. Cây phân loại được dựng theo phương pháp neighbour-joining [18], trong đó định dạng cây được tiến hành dựa trên 1000 phép so sánh đa chiều [19] bằng phần mềm Clustalx.
2.2.3. Đánh giá hiệu quả cải thiện chất lượng đất của tổ hợp vi khuẩn
Bố trí thí nghiệm: Thí nghiệm trồng cây được thực hiện trong chậu (cao 50 cm, đường kính 30 cm), mỗi chậu chứa 10 kg đất bị thoái hóa đã đập nhỏ, trộn đều với trấu hun và trấu theo tỷ lệ đất : trấu hun : trấu = 12,5:1:0,7 (w/w/w).
Cây cà chua giống Ansal 5-6 tuần được trồng với mật độ 2 cây/chậu. Mỗi lô thí nghiệm gồm 3 chậu được bố trí theo 4 công thức như sau:
- CT1: Đất không được xử lý với vi khuẩn hay phân bón
- CT2: Đất không được xử lý với vi khuẩn và được bón phân theo chế độ chăm sóc tiêu chuẩn (bón thúc bằng phân NPK).
- CT3: Đất được xử lý với vi khuẩn và được bón phân NPK theo chế độ chăm sóc tiêu chuẩn.
- CT4: Đất được xử lý với vi khuẩn và được bón phân NPK với liều lượng giảm 10%.
Sản phẩm sinh học dạng bột chứa tế bào sống của hai chủng vi khuẩn VK7 và SDT2.3 (mật độ tế bào mỗi chủng 109 CFU/g) được pha với nước sạch theo tỉ lệ 0,1%, tưới 20 mL/chậu ở thời điểm bắt đầu thí nghiệm và tưới định kỳ cùng thời điểm bón thúc phân NPK 5 ngày. Kỹ thuật trồng và chăm sóc cây cà chua được thực hiện theo tiêu chuẩn với các thời điểm bón thúc (15, 25, 45, 65 ngày). Các chậu được đặt trong nhà lưới với điều kiện có ánh nắng trực tiếp từ 6 h/ngày, tưới thường xuyên vào thời gian 6 đến 7 giờ sáng.
Đánh giá các chỉ tiêu chất lượng đất
Mẫu đất được thu ở thời điểm bắt đầu và kết thúc thí nghiệm bằng dụng cụ chuyên dụng, gạt bỏ 5 cm đất bề mặt và lấy mẫu ở độ sâu 15 cm tại 3 điểm xung quanh gốc cây. Tiến hành phân tích các chỉ tiêu: pH; hàm lượng nitơ tổng số, nitơ dễ tiêu, amoni, OM, OC và thành phần cơ giới đất.
Chỉ tiêu pH: Mẫu đất được lắc đều trong dung dịch KCl 1M theo tỷ lệ đất/KCl = 1:5 (w/v). Giá trị pH được đo bằng máy đo pH (Hanna, Mỹ) [20].
Hàm lượng nitơ tổng số được xác định theo TCVN 6498:1999 bằng phương pháp Kjeldahl cải biên thay xúc tác selen bằng xúc tác Titan dioxit (TiO2).
Hàm lượng nitơ dễ tiêu được xác định theo TCVN 5255:2009.
Hàm lượng amoni (NH4+)được xác định theo TCVN 6643:2000 dựa trên phản ứng Berthelot tạo dung dịch có màu xanh lục lam, đo ở bước sóng 660 nm.
Hàm lượng chất hữu cơ tổng số (Organic matter - OM) và carbon hữu cơ (Organic carbon - OC) được xác định theo phương pháp Walkley - Black [21].
Chỉ tiêu thành phần cơ giới đất được xác định theo TCVN 8567:2010 và phân loại đất dựa trên tam giác kết cấu đất theo nguồn Bộ Nông nghiệp Hoa Kỳ [22].
Độ ẩm của đất được xác định theo TCVN 4048:2011.
Hàm lượng kali dễ tiêu K2O được xác định theo TCVN 8662:2011.
Hàm lượng phospho dễ tiêu P2O5 được xác định theo TCVN 5256:2009.
Đánh giá vi khuẩn có lợi trong đất
Mật độ vi khuẩn tổng số, nhóm vi khuẩn cố định nitơ và nhóm vi khuẩn hòa tan phosphat được xác định vào thời điểm kết thúc thí nghiệm. Lấy 5 g đất cho vào bình tam giác 250 mL chứa 95 mL dung dịch PBS 1× và pha loãng theo hệ số thập phân. Dung dịch huyền phù (100 µL) từ các mức pha loãng được cấy trải lên các đĩa môi trường phù hợp với mỗi nhóm vi khuẩn, gồm PCA (tryptone 5 g, cao nấm men 2,5 g, glucose 1 g, agar 15 g, nước cất 1 L, pH 7,2) để đếm vi khuẩn tổng số [23], và Mannit (mannitol 10 g, KH2PO4 1 g, Na2HPO4 0,5 g, MgSO4.7H2O 0,5 g, NaCl 0,5 g, CaCl2.2H2O 0,05 g, hỗn hợp vi lượng 1 mL, bromothymol blue 0,5% (trong ethanol 99%) 2 mL, agar 15 g, nước cất 1 L, pH 7,2) để đếm vi khuẩn cố định nitơ [24] và PVK (glucose 10 g, (NH4)2SO4 0,5 g, NaCl 0,2 g, KCl 0,2 g, CaCl2.2H2O 0,1 g, MgSO4.7H2O 0,1 g, MnSO4.7H2O 0,5 g, FeSO4.7H2O 0,5 g, yeast extract 5 g, Ca3(PO4)2 5 g, bromophenol blue (BPB) 0,4%, agar 15 g, nước cất 1 L, pH 7) để đếm vi khuẩn hòa tan phosphat [25].
Đánh giá sinh trưởng của cây cà chua
Sinh trưởng của cây cà chua được đánh giá tại thời điểm kết thúc thí nghiệm (126 ngày sau trồng cây). Chiều cao cây (cm) được đo từ gốc đến đỉnh sinh trưởng. Sinh khối tươi được xác định bằng cách cân toàn bộ phần thân và lá (g/cây). Phần rễ sau khi rửa sạch và để ráo nước trên giấy thấm được đo chiều dài (cm) và cân trọng lượng tươi (g/cây). Trọng lượng quả là tổng trọng lượng quả ở các lần thu hoạch khác nhau cho tới thời điểm kết thúc thí nghiệm.
2.2.4. Xử lí số liệu
Số liệu thí nghiệm thu thập được xử lý bằng phần mềm Microsoft Excel (với chức năng xác định độ lệch chuẩn) và biểu đồ được vẽ bằng Sigma Plot 14.0.
3. KẾT QUẢ VÀ THẢO LUẬN
3.1. Đánh giá hoạt tính sinh học của hai chủng vi khuẩn VK7 và SDT2.3
Hai chủng VK7 và SDT2.3 thể hiện nhiều đặc tính có lợi cho đất và cây trồng ở các mức độ khác nhau (Bảng 2). Chủng VK7 có hoạt tính sinh IAA và sinh siderophore, có tác dụng kích thích sinh trưởng và tăng sức đề kháng của cây. Chủng SDT2.3 có các hoạt tính cố định nitơ, sinh IAA, sinh EPS và hòa tan phosphat, có tác dụng trong cải thiện chất lượng đất cũng như tăng trưởng của cây.
Bảng 2. Các hoạt tính sinh học có lợi cho đất và cây trồng của hai chủng VK7 và SDT2.3
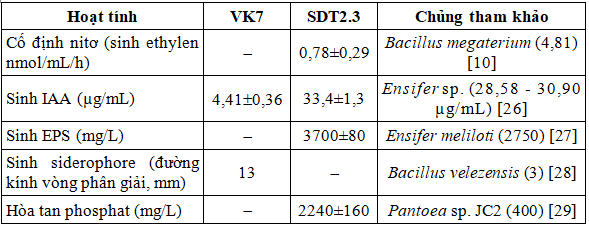
(-): không xác định
Kết quả thực nghiệm cho thấy nhiều hoạt tính như sinh IAA, sinh EPS và hòa tan phosphat ở chủng SDT2.3, cũng như hoạt tính sinh siderophore của chủng VK7 được đánh giá cao hơn nhiều chủng tham khảo đã công bố trước đây (Bảng 2). Phối hợp sử dụng hai chủng vi khuẩn sở hữu các hoạt tính khác nhau dự kiến sẽ mang lại hiệu quả tốt hơn cho đất và cây trồng so với sử dụng đơn chủng.
3.2. Định danh hai chủng vi khuẩn VK7 và SDT 2.3
Vị trí phân loại của hai chủng vi khuẩn VK7 và SDT 2.3 được xác định dựa trên so sánh trình tự gen 16S rDNA (1500 bp). Kết quả cho thấy chủng SDT2.3 gần gũi với loài Ensifer sesbaniae (100% tương đồng) với giá trị bootstrap gần như tuyệt đối 993/1000 (Hình 1C), và chủng VK7 gần gũi với loài Bacillus velezensis (99,86% tương đồng) với giá trị bootstrap 810/1000 (Hình 1A). Để có thể định danh chủng VK7 chính xác hơn chúng tôi đã tiến hành giải trình tự gen rpoB (1100 bp) như một chỉ thị phân tử khác ngoài gen 16S rDNA. Dựa trên so sánh gen rpoB, chủng VK7 có quan hệ gần gũi nhất với loài Bacillus velezensis (tương đồng 99,38%) với giá trị bootstrap 928/1000 (Hình 1B). Kết quả này hoàn toàn thống nhất với kết quả phân tích và so sánh trình tự gen 16S rDNA của chủng VK7 ở trên.
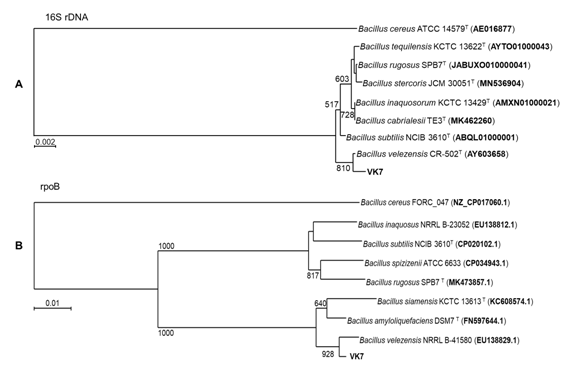
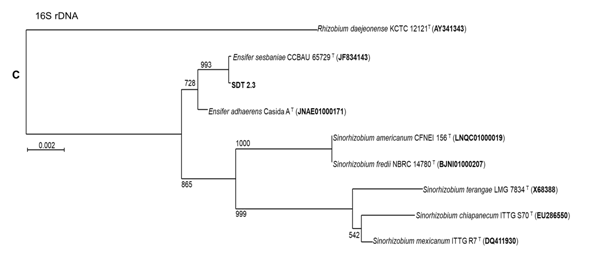
Hình 1. Cây phát sinh chủng loại của hai chủng vi khuẩn VK7 (A - Cây dựa trên trình tự gen 16S rDNA và B - Cây dựa trên trình tự gen rpoB) và chủng SDT2.3 (C - Cây dựa trên trình tự gen 16S rDNA)
Như vậy, dựa trên kết quả so sánh trình tự 16S rDNA và gen chỉ thị rpoB, hai chủng vi khuẩn sử dụng trong nghiên cứu VK7 và SDT2.3 được định danh tương ứng là Bacillus velezensis VK7 và Ensifer sesbaniae SDT2.3.
3.3. Đánh giá hiệu quả sử dụng tổ hợp hai chủng vi khuẩn trong cải thiện chất lượng đất canh tác
Sản phẩm sinh học dạng bột chứa tế bào sống của hai chủng vi khuẩn VK7 và SDT2.3 được sử dụng trong thí nghiệm trồng cây cà chua trên đất bị thoái hóa ở điều kiện nhà lưới. Hiệu quả của tổ hợp vi khuẩn được đánh giá thông qua phân tích các đặc tính lý hóa của đất kết hợp với định lượng tăng trưởng của cây.
3.3.1. Đánh giá hiệu quả qua sự thay đổi các đặc tính lý hóa của đất
Các yếu tố liên quan đến tính chất hóa lý (pH, độ ẩm), thành phần cơ giới (tỷ lệ các hạt cát, limon và sét) và thành phần dinh dưỡng (C, N, P) được xác định ở hai thời điểm trước và sau thí nghiệm. Đất sử dụng trong thí nghiệm là đất đồi chè đã bị thoái hóa, thuộc loại đất thịt pha sét (có tỷ lệ hạt cát thấp), đất chua (pH ~4) và có hàm lượng carbon hữu cơ tổng số thấp (OM<2,5%) (Bảng 1). Trong thí nghiệm trồng cây, việc trộn đất với giá thể nghèo dinh dưỡng đã cải thiện một phần thành phần cơ giới và dinh dưỡng của đất bao gồm K dễ tiêu, P dễ tiêu, OM và OC (xem các chỉ tiêu phân tích đất ban đầu ở Bảng 1 và tại thời điểm bắt đầu thí nghiệm ở công thức đối chứng CT1 trong Bảng 3.
Bảng 3. Đánh giá các chỉ tiêu lý hóa của đất trong các công thức thí nghiệm
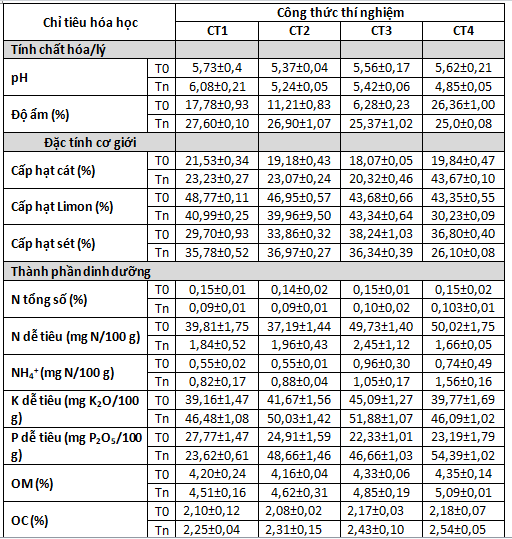
Ghi chú: T0 - thời điểm bắt đầu thí nghiệm, Tn là thời điểm kết thúc thí nghiệm.
Kết quả phân tích các chỉ tiêu đất sau 126 ngày trồng cây (Bảng 3) cho thấy độ ẩm, pH và OC của đất không có sự khác biệt đáng kể giữa lô đối chứng không bổ sung hỗn hợp vi khuẩn (CT1, CT2) và lô thí nghiệm có bổ sung hỗn hợp vi khuẩn (CT3, CT4). Tuy nhiên, độ pH của đất dao động từ 4,5 - 6 và cao hơn so với mẫu đất nguyên bản có pH 4,08. Quá trình xử lý đất đã làm tăng pH của đất trong các chậu thí nghiệm ngay từ thời điểm ban đầu. Trong quá trình trồng cây, pH giảm nhẹ ở các lô có bón phân hóa học (CT2, CT3, CT4), dao động ở mức 4,85 - 5,24 (có bổ sung hỗn hợp vi khuẩn hoặc không) so với công thức không bón phân CT1 (pH 6,08). Hàm lượng N tổng số và N dễ tiêu tại thời điểm kết thúc thí nghiệm giảm so với thời điểm ban đầu ở tất cả các công thức thí nghiệm (Bảng 3), nguyên nhân có thể là do được tiêu thụ bởi cây trồng. Hàm lượng NH4+, K dễ tiêu và P dễ tiêu tại thời điểm kết thúc thí nghiệm tăng so với thời điểm ban đầu (Bảng 3), tuy nhiên không có sự khác biệt đáng kể giữa các công thức thí nghiệm (có bổ sung hỗn hợp vi khuẩn hoặc không). Đây có thể là kết quả của việc bón thúc phân hóa học trong quá trình trồng cây. Kết quả phân tích cũng cho thấy có sự thay đổi đáng kể theo hướng tích cực ở hai chỉ tiêu là hàm lượng chất hữu cơ tổng số (OM) (Hình 2A) và thành phần cơ giới (Hình 2B) ở công thức thí nghiệm có bổ sung hỗn hợp vi khuẩn và bón phân NPK giảm 10% (CT4) so với các công thức còn lại.
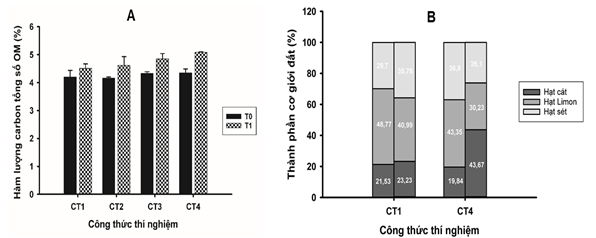
Hình 2. Hàm lượng chất hữu cơ tổng số (OM) (A) và thành phần cơ giới (B) trong đất ở thời điểm đầu và kết thúc
Chất hữu cơ trong đất (OM) bao gồm các sinh vật sống hay đã chết cùng với các sản phẩm phân hủy trung gian của chúng. OM là thành phần thiết yếu biểu hiện sức khỏe và độ phì nhiêu của đất, đóng vai trò trong nhiều mặt gồm (i) cải thiện cấu trúc đất (giúp kết tụ các hạt khoáng, tăng cường kết dính và giảm xói mòn), (ii) tăng khả năng giữ nước, và (iii) góp phần lưu giữ các thành phần dinh dưỡng hóa học [30]. Thành phần OM trong CT4 (bổ sung tổ hợp vi khuẩn và 90% phân NPK) đạt mức cao nhất là 5%, tăng thêm 17% so với thời điểm bắt đầu thí nghiệm, và tăng 12,86% so với đối chứng CT1 ở cùng thời điểm. Đóng góp vào thành phần OM chủ yếu là từ rễ cây và (có thể) các sản phẩm phân hủy trung gian dưới tác động của hệ VSV đất.
Thành phần hạt cát trong đất ở CT4 tăng 120% so với thời điểm ban đầu và tăng 87,98% so với đối chứng CT1 tại cùng thời điểm. Sau 126 ngày thí nghiệm, đất ở công thức đối chứng CT1 có tỷ lệ hạt cát/hạt limon/hạt sét là 23,23/40,99/35,78, trong khi đó tỷ lệ này trong đất ở CT4 là 43,67/30,23/26,10, tức là đất ban đầu thuộc nhóm đất thịt pha sét (tỷ lệ hạt sét trong khoảng 27-40%) có độ thoáng khí thấp đã dần được cải thiện nhờ tăng tỷ lệ hạt cát từ 23,23% lên 43,67%, trong khi giảm tỷ lệ hạt sét từ 35,78% xuống 26,1%.
3.2.2. Đánh giá hiệu quả qua sinh trưởng của cây cà chua
Cây cà chua trồng trong các chậu thí nghiệm được tách riêng phần sinh khối trên mặt đất (thân-lá, quả) và phần rễ dưới mặt đất để đánh giá hiệu quả của tổ hợp hai chủng vi khuẩn (Bảng 4).
Bảng 4. Đánh giá sinh trưởng của cây cà chua trong các công thức thí nghiệm
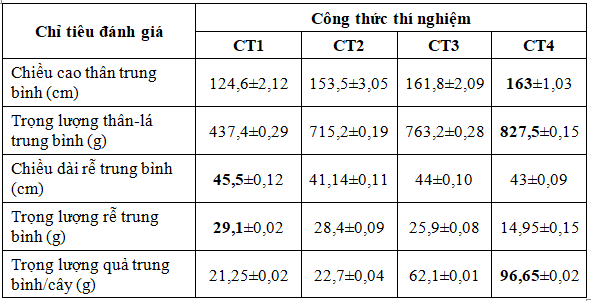
Kết quả phân tích cho thấy các công thức có bổ sung tổ hợp vi khuẩn (CT3, CT4) tăng phần sinh khối trên mặt đất (chiều cao thân, trọng lượng thân-lá, trọng lượng quả) so với các công thức đối chứng không bổ sung vi khuẩn (CT1, CT2). Sự tăng chiều cao thân và sinh khối thân-lá ở CT4 (bổ sung tổ hợp vi khuẩn, bón phân NPK giảm 10%) tương ứng thêm 6,14% và 15,70% so với CT2 (không bổ sung vi khuẩn, bón phân NPK theo tiêu chuẩn) cho thấy hiệu quả kích thích tăng trưởng của tổ hợp vi khuẩn. Về trọng lượng quả, khi có bổ sung vi khuẩn và sử dụng kết hợp phân bón NPK theo tiêu chuẩn (CT3) hay giảm 10% phân bón (CT4) thì trọng lượng quả thể hiện rất rõ ràng (bên cạnh sự gia tăng về chiều cao thân và trọng lượng thân-lá) tăng tương ứng so với CT2 là 173,6% và 325,7%. Đặc biệt chú ý là ở CT4 sử dụng tổ hợp vi khuẩn cùng với với lượng phân NPK giảm 10% nhưng tăng trưởng về sinh khối và trọng lượng quả vẫn vượt trội nhất, cao hơn cả CT3 sử dụng tổ hợp vi khuẩn với phân NPK theo tiêu chuẩn.
Tuy nhiên đối chứng (CT1) có hệ rễ phát triển mạnh nhất (cả về chiều dài rễ và trọng lượng trung bình) (Hình 3A). Trong khi đó CT4 sử dụng hỗn hợp vi khuẩn và phân NPK giảm 10% có hệ rễ phát triển kém nhất (Hình 3B). Hiện tượng rễ tăng trưởng mạnh ở CT1 có thể được giải thích do hàm lượng dinh dưỡng trong đất thấp nên cây có nhu cầu phát triển rễ sâu và rộng để thu nạp dinh dưỡng. Trong khi đó các CT2, CT3, CT4 đều được bón phân nên lượng dinh dưỡng được cung cấp đầy đủ hơn, đáp ứng nhu cầu phát triển của cây. Ở CT3 và CT4, rễ phát triển kém hơn (Hình 3B) nhưng cây tăng trưởng tốt ở phần thân và lá. Như vậy kết quả thí nghiệm chỉ ra rằng hai chủng VK7 và SDT 2.3 có khả năng kích thích phát triển thân và lá, tăng cường sinh trưởng đối với cây cà chua trong khi giảm lượng phân bón so với quy trình chăm sóc thường quy.
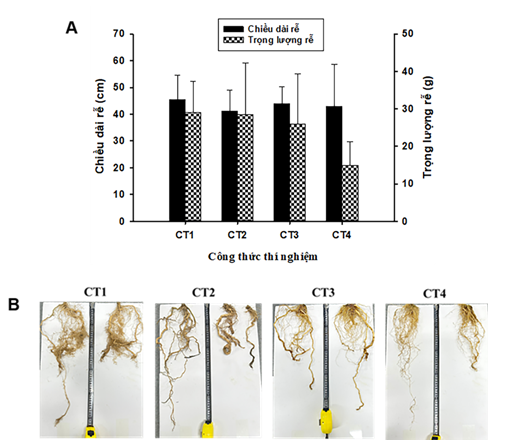
Hình 3. Tăng trưởng rễ cây cà chua trong các công thức thí nghiệm. A. Chiều dài rễ trung bình và trọng lượng rễ trung bình; B. Hình ảnh hệ rễ của các cây cà chua từ các công thức thí nghiệm
Vi khuẩn kích thích sinh trưởng thực vật kết hợp với cây trồng là cách tiếp cận an toàn và hiệu quả để cải tạo đất hoang hóa, đất bạc màu [31]. Vi khuẩn kích thích sinh trưởng thực vật theo nhiều cơ chế khác nhau, ví dụ như tăng cường thu nạp dinh dưỡng (cố định nitơ, hòa tan phosphat), sinh hormon tăng trưởng thực vật (IAA, GA), bảo vệ thực vật chống lại các tác nhân gây bệnh (nhờ các sản phẩm chuyển hóa thứ cấp có tính kháng khuẩn) [32]. Hai chủng vi khuẩn VK7 và SDT2.3 có các hoạt tính sinh học kích thích sinh trưởng thực vật được thể hiện qua kết quả đánh giá in vitro (Bảng 2). Việc nhân sinh khối và tạo sản phẩm dạng bột chứa tế bào sống của các chủng này là cách thuận tiện để đưa vào ứng dụng thực tế. Thí nghiệm đánh giá cải thiện chất lượng đất canh tác trên mô hình cây cà chua ở điều kiện nhà lưới thực hiện trong nghiên cứu này đã cho thấy hiệu quả của tổ hợp vi khuẩn trong việc kích thích tăng trưởng sinh khối thân, lá và cải thiện chất lượng đất về tính chất cơ giới (giảm tỷ lệ hạt sét, tăng tỷ lệ hạt cát làm cho đất tơi xốp hơn) và độ màu mỡ của đất (tăng hàm lượng cacbon hữu cơ). Ứng dụng vi khuẩn kích thích tăng trưởng thực vật kết hợp với các loại cây trồng khác nhau còn có thể áp dụng với nhiều loại đất canh tác bị ảnh hưởng nặng bởi các yếu tố bất lợi như thời tiết (hạn hán, nhiễm mặn) hay nhiễm các chất độc hại (chất hữu cơ độc hại hay kim loại nặng) [33].
4. KẾT LUẬN VÀ ĐỀ NGHỊ
4.1. Kết luận
- Hai chủng vi khuẩn VK7 và SDT2.3 có nhiều hoạt tính sinh học có lợi cho cây trồng, cụ thể là: chủng VK7 sinh IAA (4,41 µg/mL) và sinh siderophore với đường kính vòng phân giải 13 mm; chủng SDT2.3 cố định nitơ (0,78 nmol/mL/h), sinh IAA (33,4 µg/mL), sinh EPS (3,7 g/L) và hòa tan phosphat (2,24 g/L).
- Chủng VK7 có độ tương đồng trình tự 16S rDNA 99,86% và gen rpoB 99,38% với loài Bacillus velezensis, do vậy được định danh là Bacillus velezensis VK7. Chủng SDT2.3 có độ tương đồng trình tự 16S rDNA 100% với loài Ensifer sesbaniae và được định danh là Ensifer sesbaniae SDT2.3.
- Hiệu quả cải thiện chất lượng đất của tổ hợp hai chủng VK7 và SDT2.3 đã được đánh giá qua thí nghiệm trồng cây cà chua giống Ansal trên đất đồi chè bị thoái hóa ở điều kiện nhà lưới. Kết quả thu được như sau:
+ Cải thiện về tính chất đất: tăng hàm lượng carbon hữu cơ tổng số (16,51%) và tăng tỷ lệ hạt cát trong thành phần cơ giới của đất (120,11%).
+ Cải thiện về tăng trưởng của cây trồng: kích thích tăng trưởng sinh khối xanh của cây (thân, lá) nếu bổ sung cùng với phân bón theo tiêu chuẩn là 6,14%; và nếu bổ sung cùng với phân bón giảm 10% so với tiêu chuẩn là 15,70%.
+ Cải thiện về giảm phân bón: giúp giảm 10% lượng phân bón NPK so với chế độ chăm bón thường quy mà không ảnh hưởng đến sinh trưởng và năng suất của cây.
4.2. Đề nghị
Tiếp tục thử nghiệm đánh giá hiệu quả của tổ hợp vi khuẩn kết hợp với các loại cây trồng khác để cải tạo các loại đất bạc màu, đất nhiễm mặn/khô hạn hay đất nhiễm các chất độc hại (cacbon hữu cơ, kim loại nặng).
Lời cảm ơn: Nghiên cứu được thực hiện với sự hỗ trợ kinh phí từ đề tài “Xây dựng cơ sở dữ liệu nguồn gen vi sinh vật chất lượng cao và phát triển sản phẩm công nghệ sinh học từ vi sinh vật ứng dụng trong trồng trọt, chăn nuôi và bảo vệ môi trường” (Mã số NVQG-2021/ĐT.07) do Bộ Khoa học và Công nghệ tài trợ.
Tài liệu tham khảo
2. Doran J.W., Zeiss M.R., Soil health and sustainability: managing the biotic component of soil quality, Applied Soil Ecology, 2000, 15(1):3-11. DOI:10.1016/S0929-1393(00)00067-6.
3. Janice E. Thies, Julie M. Grossman., Biological approaches to sustainable soil systems, (Uphoff N., Ball A.S., Fernandes E., et al., eds), CRC Press, 2006.
4. M. Tahat M., M. Alananbeh K., A. Othman Y., I. Leskovar D., Soil health and sustainable agriculture, Sustainability, 2020, 12(12):4859. DOI:10.3390/su12124859.
5. Bassouny M., Chen J., Effect of long-term organic and mineral fertilizer on physical properties in root zone of a clayey Ultisol, Archives of Agronomy and Soil Science, 2016, 62(6):819-828. DOI:10.1080/03650340.2015.1085649.
6. Anand U., Vaishnav A., Sharma S.K. et al., Current advances and research prospects for agricultural and industrial uses of microbial strains available in world collections, Science of The Total Environment, 2022, 842:156641. DOI:10.1016/j.scitotenv.2022.156641.
7. Anh L.Đ.M., Anh Đ.K., Anh P.T.M. et al., Suy thoái đất đai ở Việt Nam: thực trạng và giải pháp, Đại học Quốc gia Hà Nội, 2022. DOI:https://osf.io/9bxrs
8. Wei X., Xie B., Wan C. et al., Enhancing soil health and plant growth through microbial fertilizers: Mechanisms, benefits, and sustainable agricultural practices, Agronomy, 2024, 14(3):609. DOI:10.3390/agronomy14030609.
9. Capone D.G., Determination of nitrogenase activity in aquatic samples using the acetylene reduction procedure, In: Handbook of methods in aquatic microbial ecology, 1st Edition, CRC Press, Florida, 1993, p.621-631
10. Kifle M.H., Laing M.D., Isolation and screening of bacteria for their diazotrophic potential and their influence on growth promotion of maize seedlings in greenhouses, Frontiers in Plant Science, 2016, 6:1225. DOI:10.3389/fpls.2015.01225.
11. Nguyen T.H.T., Trinh C.S., Dang T.T. et al., Indigenous diazotrophs and their effective properties for organic agriculture, Vietnam Journal of Biotechnology, 2022, 20(4):751-760.
12. Ji S.H., Gururani M.A., Chun S.-C., Isolation and characterization of plant growth promoting endophytic diazotrophic bacteria from Korean rice cultivars, Microbiological Research, 2014, 169(1):83-98. DOI:10.1016/j.micres.2013.06.003.
13. Murphy J., Riley J.P., A modified single solution method for the determination of phosphate in natural waters, Analytica Chimica Acta, 1962, 27:31-36. DOI:10.1016/S0003-2670(00)88444-5.
14. Castellane T.C.L., Persona M.R., Campanharo J.C., de Macedo Lemos E.G., Production of exopolysaccharide from rhizobia with potential biotechnological and bioremediation applications, International Journal of Biological Macromolecules, 2015, 74:515-522. DOI:10.1016/j.ijbiomac.2015.01.007.
15. Lakshmanan V., Shantharaj D., Li G., Seyfferth A.L., Janine Sherrier D., Bais H.P., A natural rice rhizospheric bacterium abates arsenic accumulation in rice (Oryza sativa L.), Planta, 2015, 242(4):1037-1050. DOI:10.1007/s00425-015-2340-2.
16. Weisburg W.G., Barns S.M., Pelletier D.A., Lane D.J., 16S ribosomal DNA amplification for phylogenetic study, Journal of Bacteriology, 1991, 173(2):697-703. DOI:10.1128/jb.173.2.697-703.1991.
17. Rooney A.P., Price N.P.J., Ehrhardt C., Swezey J.L., Bannan J.D., Phylogeny and molecular taxonomy of the Bacillus subtilis species complex and description of Bacillus subtilis subsp. inaquosorum subsp. nov., International Journal of Systematic and Evolutionary Microbiology, 2009, 59(10):2429-2436. DOI:10.1099/ijs.0.009126-0.
18. Saitou N., Nei M., The neighbor-joining method: a new method for reconstructing phylogenetic trees., Molecular Biology and Evolution, 1987. DOI:10.1093/oxfordjournals.molbev.a040454.
19. Felsenstein J., Confidence limits on phylogenies: an approach using the bootstrap, Evolution, 1985, 39(4):783-791. DOI:10.1111/j.1558-5646.1985.tb00420.x.
20. FAO., Standard operating procedure for soil pH determination, Rome, 2021, p.1-23.
21. Ummed S., Praharaj C.S., Practical manual-chemical analysis of soil and plant samples, ICAR-Indian Institute of Pulses Research Kanpur, Uttar Pradesh- 208 024, India, 2017, p.58.
22. Schoonover J.E., Crim J.F., An introduction to soil concepts and the role of soils in watershed management, Journal of Contemporary Water Research & Education, 2015, 154(1):21-47. DOI:10.1111/j.1936-704X.2015.03186.x.
23. Clark F.E., Agar-plate method for total microbial count, In: Methods of Soil Analysis: Part 2 Chemical and Microbiological Properties, 1965, p.1460-1466. DOI:10.2134/agronmonogr9.2.c48
24. Baldani J.I., Reis V.M., Videira S.S., Boddey L.H., Baldani V.L.D., The art of isolating nitrogen-fixing bacteria from non-leguminous plants using N-free semi-solid media: a practical guide for microbiologists, Plant and Soil, 2014, 384(1-2):413-431. DOI:10.1007/s11104-014-2186-6.
25. Amri M., Rjeibi M.R., Gatrouni M. et al., Isolation, identification, and characterization of phosphate-solubilizing bacteria from Tunisian soils, Microorganisms, 2023, 11(3):783. DOI:10.3390/microorganisms11030783.
26. Kaur H., Sharma P., Kaur N., Gill B.S., Tapping of native Bradyrhizobium and Ensifer sp. diversity for functional traits in soybean [Glycine max (L.) Merrill], Legume Research - An International Journal, 2014, 37(6):651. DOI:10.5958/0976-0571.2014.00691.2.
27. Moretto C., Castellane T.C.L., Lopes E.M., Omori W.P., Sacco L.P., Lemos E.G. de M., Chemical and rheological properties of exopolysaccharides produced by four isolates of rhizobia, International Journal of Biological Macromolecules, 2015, 81:291-298. DOI:10.1016/j.ijbiomac.2015.07.056.
28. Wang C., Zhao D., Qi G. et al., Effects of Bacillus velezensis FKM10 for promoting the growth of malus hupehensis rehd. and inhibiting Fusarium verticillioides, Frontiers in Microbiology, 2020, 10. DOI:10.3389/fmicb.2019.02889.
29. Damo J.L.C., Ramirez M.D.A., Agake S. et al., Isolation and characterization of phosphate solubilizing bacteria from paddy field soils in Japan, Microbes and Environments, 2022, 37(2):ME21085. DOI:10.1264/jsme2.ME21085.
30. Celestina C., Hunt J.R., Sale P.W.G., Franks A.E., Attribution of crop yield responses to application of organic amendments: A critical review, Soil and Tillage Research, 2019, 186:135-145. DOI:10.1016/j.still.2018.10.002.
31. Poria V., Dębiec-Andrzejewska K., Fiodor A. et al., Plant Growth-Promoting Bacteria (PGPB) integrated phytotechnology: A sustainable approach for remediation of marginal lands, Frontiers in Plant Science, 2022, 13:999866. DOI:10.3389/fpls.2022.999866.
32. Schirawski J., Perlin M.H., Plant-microbe interaction 2017-the good, the bad and the diverse, International Journal of Molecular Sciences, 2018, 19(5):1374. DOI:10.3390/ijms19051374.
33. Ramakrishna W., Rathore P., Kumari R., Yadav R., Brown gold of marginal soil: Plant growth promoting bacteria to overcome plant abiotic stress for agriculture, biofuels and carbon sequestration, Science of The Total Environment, 2020, 711:135062. DOI:10.1016/j.scitotenv.2019.135062.