SO SÁNH HAI MASTER MIX PCR PROBE TRONG KỸ THUẬT REAL-TIME PCR XÁC ĐỊNH BK POLYOMAVIRUS
Phòng Vi sinh và các mầm bệnh sinh học, Viện Nghiên cứu Y Dược học Quân sự, Học viện Quân y, Bộ Quốc phòng
Số 222 Phùng Hưng, Hà Đông, Hà Nội
Số điện thoại: 0904194391; Email: hangdinhbio@gmail.com
Nội dung chính của bài viết
Tóm tắt (Abstract)
COMPARISON OF TWO MASTER MIXES REAL-TIME POLYMERASE CHAIN REACTION PROBE FOR BK POLYOMAVIRUS DETECTION
Comparison of the efficiency of probe real-time PCR master mixes for BKV detection offers additional PCR reagent options for clinical laboratory tests. In the present study, AceQ qPCR Probe Master Mix was compared with QuantiTect Probe PCR Master Mix in the real-time PCR assay targeting the VP1-BKV gene. The Rotor-Gene Q platform (Qiagen, Germany) and a 10-fold serial dilution of recombinant BKV-VP1 plasmid ranging from 2.10-1 copies/µl to 2.105 copies/µl were used to evaluate. There were differences in Ct values (p<0.05) between the two master mixes but complete agreement in the performance of AceQ Probe MM compared with QuantiTect Probe MM, showing an excellent correlation with Pearson’s correlation coefficient (r) of 0.993 (p<0.0001). AceQ Probe MM as well as QuantiTect Probe MM showed good coefficient of determination (R2) values, high PCR efficiency (H%), and limit of detection at 95% confidence with R2 value of 0.994, 97.55%, LOD 95% of 0.87 (0.419-1.815) copies/µl, and R2 value of 0.991, 92.28%, LOD 1.17 (0.342-93.046) copies/µl, respectively. PCR assay running times of AceQ Probe MM and QuantiTect Probe MM were 1.17 and 1.65 hours, respectively. Furthermore, with clinical samples, Ct values comparison of all samples in which a positive result showed a high degree of linear regression analysis (r = 0.996) between the two master mixes when we evaluated eleven specimens, including plasma and urine samples from renal transplantation recipients. The Bland-Altman plot comparison showed that the average difference of -0.112 log10 BKV-DNA load, was concordance for BKV detection of two master mixes with all load differences in the range of the bias ± 1.96 SD (-0.299; 0.524). In conclusion, our study demonstrated that AceQ Probe MM and QuantiTect Probe MM were both suitable for real-time probe PCR BKV detection targeting the VP1 gene. The combination of the two probe PCR master mixes can be considered for rapid detection of BKV infection.
Từ khóa (Keywords)
BK polyomavirus, master mix, PCR probe, real-time PCR, comparison, so sánh
Chi tiết bài viết
1. ĐẶT VẤN ĐỀ
BK polyomavirus (BKV) được báo cáo lần đầu tiên vào năm 1971 tại Phòng thí nghiệm tham chiếu virus, London, Anh [1]. BKV thuộc họ Polyomaviridae, chi Polyomavirus, với hình thái điển hình của virion không có bao ngoài gồm vỏ capsid hình nhị thập diện đường kính 40 nm bao bọc hệ gen DNA sợi đôi, dạng vòng, kích thước khoảng 5 kb. Hệ gen của BKV được chia thành các vùng chính gồm vùng điều khiển không mã hóa chứa vùng khởi đầu phiên mã và các trình tự khởi động hai chiều, vùng kiểm soát sớm mã hóa kháng nguyên khối u nhỏ (StAg) và kháng nguyên khối u lớn (LTag), vùng kiểm soát muộn mã hóa protein vỏ virus (VP1-VP3) và agnoprotein [2].
BKV là virus phổ biến trong cộng đồng, với tỷ lệ huyết thanh dương tính lên tới 80% ở người trưởng thành. Người nhiễm BKV không có triệu chứng lâm sàng cụ thể, có thể gây sốt, viêm đường hô hấp trên tuy nhiên các triệu chứng này dễ nhầm lẫn với các bệnh khác [3]. Sau khi nhiễm nguyên phát, BKV tồn tại tiềm ẩn không triệu chứng và chỉ tái hoạt động ở những bệnh nhân suy giảm miễn dịch hay sử dụng thuốc ức chế miễn dịch. Ở bệnh nhân ghép thận, BKV có thể dẫn đến bệnh thận do BKV (BKV associated nephropathy, BKVN), gây hẹp niệu quản, viêm bàng quang, viêm thận kẽ và thải ghép [2].
Phát hiện và định lượng BKV-DNA trong huyết tương, nước tiểu có vai trò quan trọng trong theo dõi, giám sát BKV ở bệnh nhân sau ghép thận. Hiện nay xét nghiệm BKV-DNA từ mẫu lâm sàng được tiến hành trên các kit thương mại như RealStar (Altona Diagnostics, Germany), GeneProof (GeneProof, Czech Republic), R-gene (Argene, France),… [4, 5, 6]. Bên cạnh đó một số master mix cũng đã được sử dụng như TITANIUM Taq DNA polymerase, Bio-Rad SsoAdvanced Probes Supermix, HotStart Taq Master Mix, QuantiTect Probe PCR Master Mix cùng các mồi, probe được thiết kế đặc hiệu [3, 7, 8]. Việc tối ưu sử dụng những master mix giúp các phòng xét nghiệm chủ động trong lựa chọn sinh phẩm chẩn đoán, tuy nhiên còn ít nghiên cứu so sánh, đánh giá về hiệu quả của các master mix probe real-time PCR trong xác định BKV-DNA. QuantiTect Probe PCR Master Mix được sử dụng linh hoạt trên nhiều hệ thống real-time PCR, trong đó có Rotor-Gene Q (Qiagen, Đức) và đã được nhóm nghiên cứu sử dụng trong phát triển kỹ thuật real-time PCR định lượng nồng độ BKV-DNA [9]. Trong khi đó, AceQ qPCR Probe Master Mix là sinh phẩm mới cũng được khuyến cáo phù hợp với hệ thống Rotor-Gene Q, thời gian phản ứng nhanh và giá thành cạnh tranh. Do đó, chúng tôi thực hiện nghiên cứu này nhằm so sánh, đánh giá hai master mix AceQ qPCR Probe và QuantiTect Probe PCR trong xác định BKV-DNA bằng kỹ thuật real-time PCR.
2. VẬT LIỆU VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Vật liệu
Master mix: Hai master mix được dùng cho nghiên cứu là AceQ qPCR Probe Master Mix (Ký hiệu: AceQ Probe MM, Q112, Vazyme Biotech Co. Ltd., Nanjing, China) và QuantiTect Probe PCR Master Mix (Ký hiệu: QuantiTect Probe MM, cat. 204343, Qiagen, Hilden, Germany).
Mồi và probe: Cặp mồi, probe là qBK-F/R và đầu dò TaqMan probe qBK-Pr khuếch đại trình tự gen VP1-BKV đã được sử dụng trước đây của nhóm nghiên cứu trong phát triển kỹ thuật real-time PCR định lượng nồng độ BKV-DNA, sử dụng QuantiTect Probe MM [9].
Mẫu chứng dương DNA plasmid: Mẫu chứng dương DNA-BKV plasmid được thiết lập từ mẫu plasmid tinh khiết pGEMT-VP1 tái tổ hợp, chứa trình tự gen VP1 của BKV [10]. Plasmid được tinh sạch bằng bộ kit GeneJET Plasmid Miniprep Kit (Thermo Scientific, Mỹ) sau đó được pha loãng trong nước khử ion tạo dải nồng độ từ 10-1 đến 108 (copy/µl). Mẫu được xác định OD bằng máy đo quang phổ SpectraMax Quickdrop (Molecular Devices) với đơn vị là ng/µl. Đơn vị sử dụng nhập dữ liệu vào máy là copy/µl được quy đổi như sau:

2.2. Phương pháp nghiên cứu
Nghiên cứu được thực hiện theo phương pháp thực nghiệm mô tả, phân tích phòng thí nghiệm, lần lượt thực hiện các phản ứng real-time PCR sử dụng hệ thống Rotor-Gene Q (Qiagen, Đức) trên mẫu chứng dương DNA-BKV plasmid, DNA mẫu bệnh phẩm để xác định các chỉ số chu kỳ ngưỡng (Cycle threshold, Ct), nồng độ. Kỹ thuật real-time PCR xác định BKV- DNA sử dụng AceQ Probe MM được khảo sát lần lượt nồng độ mồi qBK(F+R) từ 0,1 đến 1,0 µM (nồng độ probe 0,1 µM); probe qBK-Pr từ 0,05 đến 0,25 µM trên mẫu chứng dương plasmid DNA-BKV được pha loãng đến nồng độ 2x103 copy/µl ký hiệu là E3 (Bảng 1), nồng độ mồi, probe được lựa chọn là nồng độ mà tại đó cho tín hiệu huỳnh quang ổn định và giá trị Ct nhỏ nhất.
Kỹ thuật real-time PCR xác định BKV- DNA sử dụng AceQ Probe MM được so sánh với kỹ thuật real-time PCR sử dụng QuantiTect Probe MM đã được nhóm nghiên cứu thiết lập trước đó. Cụ thể, phản ứng real-time QuantiTect Probe MM có thành phần: 1X QuantiTect Probe MM; 0,2 μM mồi xuôi, mồi ngược mỗi loại; 0,05 μM probe; 5 μl ADN khuôn, nước khử ion không lẫn DNAase/RNAse được bổ sung đến thể tích 20 μl, với chu trình nhiệt (50oC-5 min) x 1 chu kỳ, (95oC-15 min) x 1 chu kỳ, (94oC-15 s, 58oC-40 s) x 45 chu kỳ được thực hiện trên máy real-time PCR Rotor-Gene Q (Qiagen, Đức). Kỹ thuật real-time QuantiTect Probe MM này với ngưỡng phát hiện 1 copy/µl trên panel mẫu, độ tin cậy 95%, đã được đánh giá cho kết quả tương đương so với kit RealStar® BKV PCR 1.0 (Altona- Đức) trên mẫu bệnh phẩm lâm sàng [9].
Bảng 1. Khảo sát các thành phần phản ứng real-time PCR với AceQ qPCR Probe Master Mix
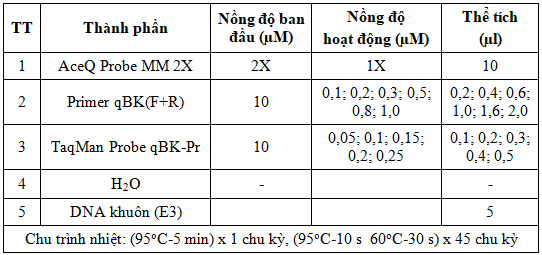
Để so sánh hai master mix, phản ứng real-time PCR sử dụng AceQ Probe MM và QuantiTect Probe MM được đánh giá đồng thời trên mẫu chứng dương DNA plasmid dải nồng độ từ 2x10-1 copy/µl đến 2x105 copy/µl (ký hiệu từ E-1 đến E5) để xây dựng đường hồi quy tuyến tính, xác định hệ số tương quan (R2) và hiệu suất phản ứng H%; dải nồng độ từ 2x10-3 copy/µl đến 2x102 copy/µl (ký hiệu từ E-3 đến E2), mỗi mẫu được chạy lặp lại hai lần trong cùng một lần chạy và lặp lại thí nghiệm 6 lần để xác định giới hạn phát hiện LOD. Đồng thời, phản ứng real-time PCR sử dụng hai master mix cũng được đánh giá trên DNA-BKV tách chiết từ 11 mẫu bệnh phẩm huyết tương, nước tiểu của bệnh nhân sau ghép thận. Trong các thí nghiệm, mỗi mẫu được chạy lặp lại hai lần trong cùng một lần chạy và lặp lại thí nghiệm ít nhất 2 lần để tính giá trị trung bình.
Số liệu được thống kê trong phần mềm Microsoft Excel 2019, phân tích bằng Graphpad Prism 9.5, phân tích sự khác biệt giá trị trung bình Ct bằng Paired t-Test, xác định hệ số tương quan (R2) và hiệu suất phản ứng (H%), đánh giá sự đồng nhất của hai kỹ thuật sử dụng master mix AceQ qPCR Probe và QuantiTect Probe PCR bằng biểu đồ Bland- Altman, kết quả định lượng đồng nhất khi các giá trị phân tích Bland-Altman nằm trong phạm vi khác biệt trung bình ±1,96 độ lệch chuẩn (bias ± 1,96 SD), sử dụng công cụ Quodata để xác định LOD.
3. KẾT QUẢ VÀ THẢO LUẬN
3.1. Thiết lập kỹ thuật real-time PCR xác định BKV-DNA sử dụng AceQ qPCR Probe Master Mix
Trước khi so sánh hai master mix, đối với AceQ Probe MM, kỹ thuật real-time PCR xác định DNA-BKV cần được khảo sát lần lượt với nồng độ mồi và probe. Kết quả real-time PCR khảo sát nồng độ mồi và probe sử dụng AceQ Probe MM được tổng hợp ở Bảng 2.
Bảng 2. Kết quả khảo sát nồng độ mồi, probe
sử dụng AceQ qPCR Probe Master mix
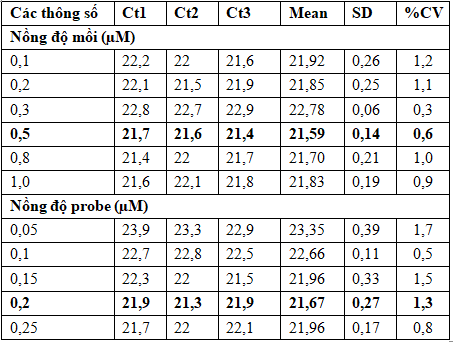
Chú thích: Ct: Chu kỳ ngưỡng; Mean: Trung bình; SD: Độ lệch chuẩn; CV: Hệ số biến thiên.
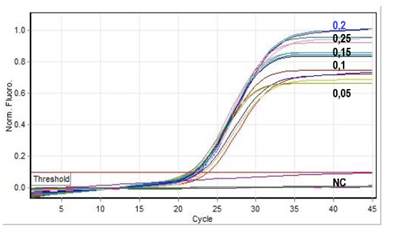
Hình 1. Đồ thị huỳnh quang khuếch đại gen VP1-BKV bằng phản ứng real-time PCR trên mẫu chứng dương E3 với các nồng độ probe 0,05; 0,1; 0,15; 0,2; 0,25 µM sử dụng AceQ Probe MM, NC: Đối chứng âm.
Kết quả khảo sát nồng độ mồi ở các mức 0,1; 0,2; 0,3; 0,5; 0,8; 1,0 µM cho thấy, tại nồng độ mồi 0,5 µM Ct có giá trị nhỏ nhất (CV=0,6%). Do đó, nồng độ mồi 0,5 µM có độ tin cậy cao nhất, được lựa chọn trong các phản ứng khảo sát nồng độ probe. Tương tự, kết quả khảo sát nồng độ probe ở các mức 0,05; 0,1; 0,15; 0,2; 0,25 µM cho thấy, nồng độ probe 0,2 µM có giá trị Ct nhỏ nhất (CV=1,3%) (Hình 1). Như vậy, trong nghiên cứu này chúng tôi đã thiết lập được phản ứng real-time PCR xác định BKV-DNA với nồng độ mồi 0,5 µM và probe 0,2 µM khi sử dụng AceQ Probe MM.
3.2. Đánh giá kỹ thuật real-time PCR xác định BKV-DNA sử dụng hai loại master mix trên bộ mẫu chứng dương plasmid
Kết quả real-time PCR xác định BKV- DNA sử dụng hai loại master mix chạy lặp lại trên dải nồng độ plasmid pha loãng từ 2x10-1 đến 2x105 copy/µl (E-1-E5) được phân tích, so sánh giá trị Ct trung bình. Số liệu Bảng 3 cho thấy, giá trị trung bình Ct của QuantiTect Probe MM là 26,93 (23,81-30,05) lên sớm hơn Ct của AceQ Probe MM là 27,92 (25,08-30,75) khoảng -0,988 (-1,447 - -0,53) chu kỳ ở dải nồng độ từ 2x10-1 đến 2x105 copy/µl và có sự khác biệt về giá trị trung bình khi sử dụng hai loại master mix (p<0,05). Sự khác biệt này có thể do thành phần của các master mix khác nhau trong đó có Taq DNA polymerase và đệm PCR. Điều này cũng được phản ánh qua nghiên cứu của Wolffs và cộng sự [11]. Tuy nhiên, hệ số tương quan Pearson 0,993 (p<0,0001) cho thấy mối tương quan tuyến tính rất mạnh giữa các giá trị Ct khi sử dụng hai loại master mix (Hình 2A).
Bảng 3. So sánh kỹ thuật real-time PCR xác định BKV- DNA sử dụng hai loại master mix trên bộ mẫu chứng dương plasmid từ 2x10-1 copy/µl đến 2x105 copy/µl
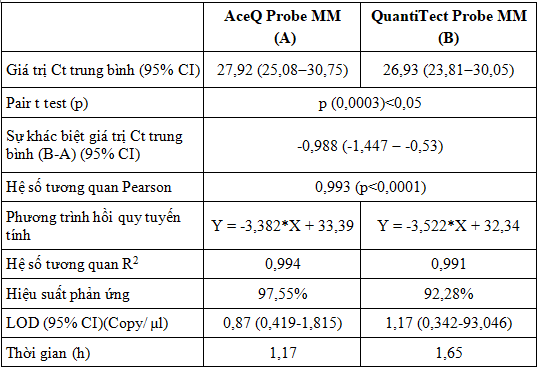
Chú thích: 95% CI: Khoảng tin cậy 95%.
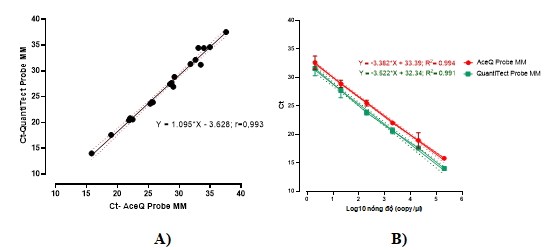
Hình 2. A) Mối tương quan giữa các giá trị Ct của hai master mix. B) Đường chuẩn cho hai master mix khi đánh giá trên mẫu chứng dương plasmid
Phân tích hồi quy tuyến tính giữa giá trị Ct và nồng độ (giá trị log10 nồng độ) của từng master mix cho thấy mối tương quan tuyến tính mạnh giữa hai giá trị tương ứng. Cả hai master mix đều có hệ số tương quan và hiệu suất phản ứng cao (AceQ Probe MM có R2 = 0,994; H% = 97,55; QuantiTect Probe MM có R2 = 0,991; H% = 92,28) chứng tỏ quá trình khuếch đại gen mục tiêu cũng như kỹ thuật thao tác tốt (Hình 2B). Sử dụng công cụ Quodata, giá trị LOD 95% của phản ứng real-time PCR BKV-DNA sử dụng AceQ Probe MM và QuantiTect Probe MM được xác định lần lượt là 0,87 (0,419-1,815) và 1,17 (0,342-93,046) copy/µl. So với nghiên cứu các master mix cho real-time PCR trong xác định BKV như Bio-Rad SsoAdvanced Probes Supermix với đường chuẩn có slope -3,5; intercept 43; R2= 0,99, H%= 91,8; LOD 95% là 125 copy/ml [7]; hay TITANIUM Taq DNA polymerase kèm TITANIUM Taq PCR buffer (Clontech Laboratories, Inc, Mountain View, California) có R2 = 0,99, H% = 91,01; LOD < 500 copy/ml [8]. Qua đó, chúng tôi thấy rằng kết quả của nhóm nghiên cứu là tương đương và đáng tin cậy.
Về thời gian thực hiện phản ứng, kỹ thuật real-time PCR sử dụng AceQ Probe MM có thời gian phản ứng nhanh hơn QuantiTect Probe MM là 0,48 giờ (1,17< 1,65 giờ), giúp rút ngắn thời gian quá trình xét nghiệm.
3.3. Đánh giá kỹ thuật real-time PCR xác định BKV-DNA trên mẫu lâm sàng
Kỹ thuật real-time PCR xác định BKV-DNA sử dụng hai loại master mix ngoài đánh giá trên mẫu chứng dương plasmid còn được đánh giá trên mẫu DNA-BKV tách chiết từ 11 mẫu bệnh phẩm huyết tương, nước tiểu của bệnh nhân sau ghép thận. Trong 11 mẫu DNA-BKV tách chiết từ bệnh phẩm lâm sàng được sử dụng, master mix AceQ qPCR Probe và QuantiTect Probe PCR đều cho kết quả đồng dương tính với 09 mẫu (master mix AceQ qPCR Probe có giá trị Ct trong khoảng 11,13 từ 32,63), và kết quả đồng âm tính với 02 mẫu. Hai mẫu đồng âm này đều là huyết tương, trong đó có 01 mẫu với master mix AceQ qPCR Probe cho tín hiệu huỳnh quang giá trị Ct cao (Ct = 36,74) còn master mix QuantiTect Probe PCR không có tín hiệu. Tuy nhiên, giá trị Ct này với master mix AceQ qPCR Probe tương đương nồng độ 0,051 copy/µl (dưới ngưỡng phát hiện), nên vẫn được xác định là âm tính. Chỉ số Ct của hai master mix khác nhau nguyên nhân có thể do sự sai khác về thành phần của hai master mix. Kết quả này cũng có thể do mẫu huyết tương nồng độ rất thấp, số bản sao BKV-DNA không đủ để phản ứng PCR có thể phát hiện. Điều này cũng được thể hiện qua nghiên cứu của So Ji Kang trên gen ND5 [12]. Như vậy, xét trên tổng thể, có sự đồng thuận tốt về hiệu suất của hai master mix thể hiện qua mối quan hệ tuyến tính mạnh với hệ số tương quan 0,996 (Hình 3A).
Để xác định liệu có sự khác biệt của giá trị nồng độ giữa hai master mix, chúng tôi đã đánh giá song song thông qua biểu đồ Bland-Altman. Khảo sát mức độ chênh lệch giá trị nồng độ (log10) của AceQ Probe MM và QuantiTect Probe MM, sự khác biệt trung bình (hiệu số của nồng độ C- AceQ Probe MM - C QuantiTect Probe MM) là 0,112. Kết quả cho thấy, không có điểm nào vượt ra ngoài giới hạn của sai biệt cho phép, tương đương 100% điểm nằm trong khoảng sai biệt ULOA và LLOA (-0,299; 0,524) (Hình 3B).
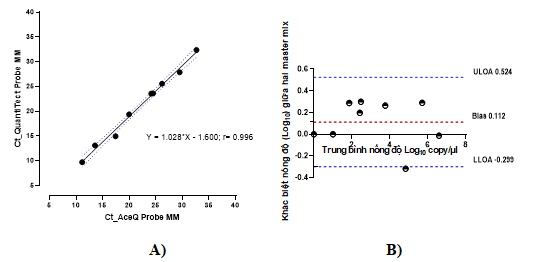
Hình 3. A) Mối tương quan giữa các giá trị Ct của hai master mix đánh giá trên mẫu lâm sàng; B) Biểu đồ Bland- Altman đánh giá sự tương đồng giá trị nồng độ (log10 copy/µl) của hai master mix trên mẫu bệnh phẩm dương tính, đường nét đỏ biểu diễn khác biệt trung bình (Bias), đường nét xanh biểu diễn cho giá trị khác biệt trung bình ± 1,96 SD (Upper/Lower 95% Limits of Agreement ULOA/ LLOA)
Kết quả đánh giá bước đầu cho thấy hiệu quả của hai master mix trong phản ứng real-time PCR xác định BKV-DNA với gen đích VP1 là tương đương nhau, QuantiTect Probe MM có giá trị Ct sớm hơn AceQ Probe MM khoảng -0,988 (-1,447 - -0,53) chu kỳ, nhưng kết quả phát hiện BKV trên 11 mẫu lâm sàng của hai master mix là đồng nhất. Tuy nhiên, kết quả đánh giá sẽ chính xác hơn khi được thực hiện trên số mẫu bệnh phẩm nhiều hơn, từ đó có thể khảo sát về đa dạng các kiểu gen, subtype của BKV [4], [7], cũng như độ ổn định trong chẩn đoán của các master mix theo thời gian.
4. KẾT LUẬN
Hai master mix AceQ qPCR Probe và QuantiTect Probe PCR có sự khác biệt về giá trị Ct trung bình (p<0,05), nhưng có mối tương quan tuyến tính rất mạnh với hệ số tương quan Pearson r 0,993 (p<0,0001)). Xét riêng từng loại, cả AceQ Probe MM và QuantiTect Probe MM đều cho hệ số tương quan tốt, hiệu suất phản ứng cao, LOD 95% lần lượt là R2 = 0,994; H% = 97,55; LOD 0,87 (0,419-1,815) copy/µl và R2 = 0,991; H% = 92,28, LOD 1,17 (0,342-93,046) copy/µl, thời gian phản ứng với AceQ Probe MM nhanh hơn QuantiTect Probe MM là 0,48 giờ, có tiềm năng ứng dụng thực tế. Có sự tương quan cao giữa các giá trị Ct r = 0,996 và phù hợp phát hiện BKV trên mẫu lâm sàng với hai loại master mix khi phân tích biểu đồ Bland-Altman cho thấy tất cả các giá trị khác biệt nồng độ đều nằm trong giới hạn bias ± 1,96 SD (-0,2999; 0,524). Như vậy, cả hai master mix đều có khả năng xác định BKV bằng real-time PCR sử dụng gen đích VP1, có thể xem xét việc sử dụng kết hợp các master mix này trong xét nghiệm xác định BKV.
Lời cảm ơn: Công trình này được hoàn thành nhờ sự hỗ trợ từ đề tài Khoa học và Công nghệ cấp Học viện Quân y, Bộ Quốc phòng năm 2024-2025.
Tài liệu tham khảo
2. Hirsch, H.H., BK virus: opportunity makes a pathogen, Clin. Infect. Dis., 2005, 41(3):354-60. DOI: 10.1086/431488
3. Sawinski, D. and S. Goral, BK virus infection: an update on diagnosis and treatment, Nephrol. Dial. Transplant, 2015, 30(2):209-17. DOI: 10.1093/ndt/gfu023
4. Descamps, V., E. Martin, V. Morel, et al., Comparative evaluation of three nucleic acid-based assays for BK virus quantification, J. Clin. Microbiol., 2015, 53(12):3822-7. DOI: 10.1128/JCM.02116-15
5. Hasan, M.R., R. Tan, G. Al-Rawahi, et al., Comparative evaluation of laboratory developed real-time PCR assays and RealStar((R)) BKV PCR Kit for quantitative detection of BK polyomavirus, J. Virol. Methods., 2016, 234:80-6. DOI: 10.1016/j.jviromet.2016.04.009
6. Rennert, H., S.G. Jenkins, C. Azurin, et al., Evaluation of a BK virus viral load assay using the QIAGEN Artus BK Virus RG PCR test, J. Clin. Virol., 2012, 54(3):260-4. DOI: 10.1016/j.jcv.2012.03.007
7. Bateman, A.C., A.L. Greninger, E.E. Atienza, et al., Quantification of BK virus standards by quantitative real-time PCR and droplet digital PCR is confounded by multiple virus populations in the WHO BKV international standard, Clin. Chem., 2017, 63(3):761-769. DOI: 10.1373/clinchem.2016.265512
8. Gu, Z., J. Pan, M.J. Bankowski, et al., Quantitative real-time polymerase chain reaction detection of BK virus using labeled primers, Arch. Pathol. Lab. Med., 2010, 134(3):444-8. DOI: 10.5858/134.3.444
9. Hoàng Xuân Sử, Trịnh Thị Mỹ Anh, Nguyễn Sỹ Lánh, Phạm Quốc Toản, Nguyễn Giang Hòa, Đinh Thị Thu Hằng, Nghiên cứu định lượng nồng độ ADN BK polyomavirus bằng kỹ thuật Taqman probe real-time PCR, Tạp chí Y Dược học Quân sự, 2018, 5(29):29-36.
10. Đinh Thị Thu Hằng, Hoàng Xuân Sử, Đặc điểm kiểu gen của BK polyomavirus trên bệnh nhân sau ghép thận ở miền Bắc Việt Nam, Tạp chí Khoa học ĐHQGHN: Khoa học Y Dược, 2018, 34(1):89-95. DOI:10.25073/2588-1132/vnumps.4104
11. Wolffs, P., H. Grage, O. Hagberg, et al., Impact of DNA polymerases and their buffer systems on quantitative real-time PCR, J. Clin. Microbiol., 2004, 42(1):408-11. DOI: 10.1128/JCM.42.1.408-411.2004
12. Kang, S.J., C.S. Jang, J.M. Son, et al., Comparison of seven commercial taqman master mixes and two real-time PCR platforms regarding the rapid detection of porcine DNA, Food Sci. Anim. Resour., 2021, 41(1):85-94. DOI: 10.5851/kosfa.2020.e80