NGHIÊN CỨU CHẾ TẠO VÀ ĐÁNH GIÁ MỘT SỐ CHỈ TIÊU CỦA XỐP CẦM MÁU CẤU TẠO TỪ CHITOSAN
Trung tâm Nhiệt đới Việt - Nga
Số 63, Nguyễn Văn Huyên, Nghĩa Đô, Cầu Giấy, Hà Nội, Việt Nam
Số điện thoại: 0356113219; Email: thuytrang.ttndvn@gmail.com
Nội dung chính của bài viết
Tóm tắt (Abstract)
STUDY ON PRODUCTION AND EVALUATION OF CHITOSAN HEMOSTATIC SPONGE
This study presented the results of producing a hemostatic sponge based on chitosan by the freeze-drying method. The morphology, pore size, swelling ratio, in vitro blood clotting test, and in vivo hemostatic assay of the product were evaluated. Results showed the sponge has a uniform porous structure with a pore size range between 40µm and 170µm and a high swelling ratio (23 times). In vitro blood clotting tests show that the sponge has fast blood clotting time (≤ 40 seconds). In vivo studies were conducted on a rat femoral artery injury model, the product was effective in controlling bleeding, stopping bleeding 3.3 times faster, and reducing bleeding volume by 8.5 times compared to the batch using medical gauze.
Từ khóa (Keywords)
Chitosan hemostatic sponge, freeze-drying, emergency hemostatic, xốp cầm máu chitosan, đông khô, cầm máu khẩn cấp
Chi tiết bài viết
1. ĐẶT VẤN ĐỀ
Cầm máu là một bước trong quy trình chăm sóc y tế khẩn cấp [1]. Việc cầm máu hiệu quả và nhanh chóng là cực kỳ quan trọng đối với hoạt động phẫu thuật và cấp cứu do chấn thương, đặc biệt trên chiến trường hay các tình huống phức tạp khác như tai nạn hoặc thiên tai [2, 3]. Các nghiên cứu lâm sàng đã chỉ ra rằng xuất huyết là nguyên nhân gây tử vong do chấn thương đứng thứ hai ở người, chiếm 15% tổng số ca [2, 3].
Chitosan là một loại polyme sinh học có nguồn gốc từ chitin, được tìm thấy trong vỏ của các loài giáp xác như tôm và cua [4]. Trong thập kỷ qua, chitosan đã được sử dụng như một chất nền để chế tạo thành công nhiều loại vật liệu chức năng và sinh học khác nhau như hydrogel, aerogel. Chúng được chế tạo ở dạng sợi, dạng xốp và có đặc tính cầm máu tốt, kháng khuẩn, khả năng tương thích sinh học và phân hủy sinh học cao [1, 5, 6]. Cơ chế cầm máu của chitosan thông qua sự tương tác tĩnh điện giữa phân tử chitosan tích điện dương và các tế bào hồng cầu tích điện âm gây ra sự tập trung hồng cầu xung quanh vết thương để hình thành cục máu đông [7]. Ngoài ra, chitosan có thể hoạt hóa, đẩy nhanh quá trình kết dính và kết tập của các tiểu cầu từ đó kích hoạt hệ thống đông máu nội tại [1, 8, 9]. Hiện nay, một số sản phẩm cầm máu khẩn cấp từ chitosan như Xstat, Hemcon, Celox... đã được phát triển thành công và sử dụng rộng rãi trong quân sự, cũng như sơ cấp cứu trước khi nhập viện [1].
So với các sản phẩm cầm máu khác, xốp cầm máu chitosan đã được chứng minh có hiệu quả cầm máu tốt, thúc đẩy quá trình làm lành vết thương nhờ khả năng hấp thụ dịch nhanh, hình dạng và kích thước linh hoạt [10-13]. Song và cộng sự [14] đã chế tạo thành công một loại xốp cầm máu gốc chitosan trong CO2 siêu tới hạn, có độ xốp 80%, thời gian cầm máu 70 giây với mô hình chảy máu động mạch đùi chuột. Mặc dù, công trình này đã cung cấp một phương án khả thi để chế tạo xốp cầm máu chitosan nhưng vẫn còn những hạn chế về thiết bị và hóa chất sử dụng, khó có thể mở rộng quy mô [1].
Nghiên cứu này trình bày các kết quả chế tạo xốp cầm máu từ chitosan bằng phương pháp đông khô, sử dụng những nguyên liệu an toàn, giá rẻ, sẵn có trên thị trường. Sản phẩm chế thử được đánh giá khả năng thấm hút, độ bền cơ học, thời gian đông máu in vitro và tác dụng cầm máu trên động vật thực nghiệm.
2. VẬT LIỆU VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Vật liệu, hóa chất, động vật dùng trong nghiên cứu
Chitosan (độ deacetyl hóa từ 85% đến 95%, Việt Nam), glycerol (độ tinh khiết ≥ 99%, Merck, Đức), acid acetic (độ tinh khiết ≥ 99%, Merck, Đức), nước cất hai lần (Việt Nam), dung dịch đệm phosphat (PBS) (pH 7,4, Bioreagents, Mỹ), gạc y tế vô trùng (Việt Nam), ketamin hydroclorid (Rotexmedia, Đức), nước muối sinh lý (Việt Nam), xilanh 5 mL (Việt Nam).
Chuột cống trắng chủng Wistar (không phân biệt giống, 8-10 tuần tuổi, trọng lượng 200±20 g) và thỏ thí nghiệm (12-14 tháng tuổi, trọng lượng 1,9±0,1 kg) do Trung tâm Nghiên cứu động vật thực nghiệm - Học viện Quân y cung cấp.
2.2. Phương pháp nghiên cứu
2.2.1. Quy trình chế tạo xốp cầm máu: Chitosan (khối lượng từ 15 g đến 60 g) được hòa tan trong 1500 mL dung dịch acid acetic 1% bằng máy khuấy cơ (1000 vòng/min) ở nhiệt độ phòng trong thời gian 5 h, bổ sung 10 g glycerol vào hỗn hợp và tiếp tục khuấy trong 3 h. Dung dịch được đổ vào khuôn, đông lạnh (-80oC; 1,5 h), tháo khuôn và đông khô bằng thiết bị Biobase BK-FD12S ở áp suất 1 Pa, thu được xốp cầm máu. Sản phẩm được đóng gói và tiệt trùng bằng tia gamma ở mức liều 25 kGy.

Hình 1. Quá trình chế tạo xốp cầm máu
2.2.2. Kiểm tra hình thái học: Hình thái học của mẫu được chụp trên kính hiển vi điện tử quét SEM (S-3400N, Hitachi, Nhật Bản) ở 5 kV cho bề mặt và mặt cắt dọc của miếng xốp. Các mẫu được phủ một lớp bạc siêu mỏng lên bề mặt trong thiết bị phủ trước khi tiến hành kiểm tra.
2.2.3. Hàm ẩm của miếng xốp: Hàm ẩm của miếng xốp được thực hiện bằng phương pháp mất khối lượng do làm khô, theo Phụ lục 9.6 của TCVN I-1:2017 [15] ở nhiệt độ sấy là (105 ± 2)oC trong thời gian 5 h, sau đó làm nguội trong bình chân không, xác định khối lượng mẫu sau khi sấy. Tính hàm ẩm của miếng xốp theo công thức:
![]()
(1)
Trong đó: D là hàm ẩm (%); mo là khối lượng của mẫu ban đầu (g); m1 là khối lượng mẫu sau khi sấy (g).
2.2.4. Tính chất cơ học của miếng xốp: Xốp cầm máu được cắt thành hình chữ nhật (kích thước dài × rộng: 80 mm × 25 mm). Tiến hành đo độ bền kéo trên thiết bị máy kéo đa năng Zwick/Roell Z010 (Đức), theo tiêu chuẩn ASTM D882:2002 [16] với tốc độ 2 mm/min ở nhiệt độ phòng. Độ bền kéo (σ) của mẫu được tính theo công thức sau:

Trong đó: F là lực kéo đứt vật liệu (N) có thiết diện A (mm2).
2.2.5. Khả năng thấm hút: Cân chính xác khối lượng của 1 miếng xốp khô (W0), sau đó nhúng vào cốc có mỏ chứa 200 mL dung dịch PBS (pH 7,4) ở 32 °C trong 30 min. Sau đó, lấy mẫu ra khỏi cốc và đặt trên một giá lưới thép. Để ráo nước trong 1 min và xác định khối lượng mẫu (W1) Khả năng thấm hút của mẫu được tính theo công thức sau [13]:

Trong đó: W là khả năng thấm hút (lần); W1 là khối lượng của miếng xốp ướt (g); W0 là khối lượng của miếng xốp khô (g).
2.2.6. Thời gian đông máu in vitro: Thử nghiệm được tiến hành với xốp cầm máu và gạc y tế vô trùng làm đối chứng. Lấy 3 mL máu tĩnh mạch của thỏ bằng xilanh 5 mL. Đặt các vật liệu cầm máu (3 cm × 3 cm) vào đĩa petri, nhỏ 0,5 mL máu vào chính giữa và bắt đầu đếm thời gian. Quan sát trạng thái máu ở các vật liệu cầm máu để bổ sung dung dịch nước muối sinh lý vào các đĩa petri. Sau khi bổ sung dung dịch nước muối, trường hợp máu chưa đông thì dung dịch chuyển sang màu hồng [17]. Thời gian đông máu là thời gian ngắn nhất mà máu không bị hòa tan vào dung dịch nước muối sinh lý.
2.2.7. Đánh giá tác dụng cầm máu của các chế phẩm trên chuột cống trắng: Tác dụng cầm máu của các chế phẩm nghiên cứu được đánh giá trên chuột cống trắng theo phương pháp được mô tả bởi Pogorielov và cộng sự [18].
Chuột được chia thành 2 lô, mỗi lô 10 con. Lô chứng được cầm máu bằng gạc y tế, lô nghiên cứu được cầm máu bằng xốp cầm máu. Vật liệu cầm máu được chuẩn bị với kích thước 2,5 cm × 2,5 cm và được cân khối lượng trước khi tiến hành thí nghiệm.
Gây chảy máu chuột: Chuột được gây mê bằng ketamin hydroclorid (10 mg/kg). Cạo sạch vùng lông giữa đùi, bộc lộ động mạch đùi nông, dùng kéo cắt một nửa đường kính động mạch đùi nông ở phần giữa.
Chuột ở các lô được cầm máu bằng cách giữ ép chuẩn (SMC). Ở tất cả các lô, SMC được tiến hành trong 60 s, nếu máu tiếp tục chảy, SMC được áp dụng thêm 60 s. Nếu không cầm máu được sau 10 min thì kết luận là xuất huyết không kiểm soát được. Xác định khối lượng của vật liệu cầm máu trước và sau thử nghiệm để đánh giá lượng máu mất theo công thức sau:

Trong đó: S là lượng máu mất (mg); W1 là khối lượng mẫu trước thử nghiệm (mg); W2 là khối lượng mẫu sau khi thử nghiệm (mg).
2.2.8. Xử lý số liệu
Số liệu thu thập được xử lý bằng phần mềm Microsoft Excel 2010 và SPSS 20.0, sử dụng thuật toán t-test student và One - Way Anova để so sánh giá trị trung bình. Số liệu được trình bày dưới dạng Mean ± SD. Khác biệt có ý nghĩa thống kê khi p < 0,05.
3. KẾT QUẢ VÀ BÀN LUẬN
3.1. Khảo sát các thông số ảnh hưởng đến khả năng tạo xốp từ chitosan
3.1.1. Khảo sát ảnh hưởng của nồng độ dung dịch chitosan
Trong thí nghiệm này thời gian đông khô được cố định là 50 h, dung dịch chitosan được khảo sát với các nồng độ từ 1% đến 4%. Đánh giá hình dạng và trạng thái của miếng xốp để xác định nồng độ chitosan phù hợp.
Bảng 1. Kết quả khảo sát ảnh hưởng của nồng độ chitosan đến hình dạng miếng xốp
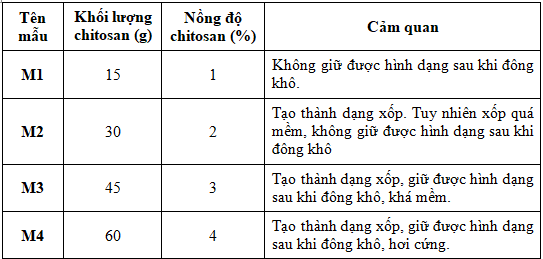
Kết quả khảo sát ở Bảng 1 cho thấy, nồng độ của chitosan ảnh hưởng trực tiếp đến chất lượng của miếng xốp. Với nồng độ thấp (1% và 2%), sản phẩm không tạo thành dạng xốp, khó giữ được hình dạng sau khi đông khô. Do sau quá trình đông khô vật liệu bị co ngót. Ở nồng độ chitosan cao hơn (4%) trạng thái xốp thu được cứng, không thuận tiện để sử dụng. Để miếng xốp tạo ra giữ được hình dạng, mềm, thích hợp sử dụng làm miếng xốp cầm máu, chúng tôi lựa chọn nồng độ dung dịch chitosan 3%. Tại nồng độ này, độ co ngót trên mỗi cạnh của miếng xốp là 6-7%.
3.1.2. Khảo sát ảnh hưởng của thời gian đông khô đến chất lượng miếng xốp
Thời gian đông khô là yếu tố quan trọng đối với quy trình chế tạo miếng xốp. Khi thời gian chưa đủ trên bề mặt miếng xốp sẽ xuất hiện những mảng ướt (Hình 1). Miếng xốp đạt yêu cầu có màu trắng ngà, cấu trúc xốp, đồng nhất và không có mảng ướt. Chúng tôi đã khảo sát thời gian đông khô từ 24 h đến 72 h, các kết quả đánh giá chỉ tiêu chất lượng của miếng xốp như sau:
Bảng 2. Kết quả khảo sát ảnh hưởng của thời gian đông khô
đến chất lượng miếng xốp

Bảng 2 cho thấy, với các mẫu đông khô từ 24 h đến 42 h, miếng xốp xuất hiện nhiều mảng ướt, trạng thái mềm, không đạt yêu cầu chất lượng. Các mẫu đông khô từ 48 h đến 72 h không xuất hiện các mảng ướt, độ cứng đạt yêu cầu. Các kết quả nghiên cứu chỉ ra rằng, tại thời điểm 48 h độ bền kéo và khả năng thấm hút của miếng xốp là tốt nhất, lần lượt là 23,1 N và 23,11 lần. Tăng thời gian đông khô độ bền của miếng xốp cầm máu càng giảm cụ thể tại thời điểm 54 h độ bền kéo của miếng xốp đạt 14 N, tại thời điểm 60 h là 11,2 N, các thời điểm 66 h và 72 h lần lượt là 9,8 N và 7,5 N. Nguyên nhân là do khi thời gian đông khô tăng hàm ẩm của miếng xốp giảm từ 15,8% (48 h) đến 13,1% (72 h), khi hàm ẩm giảm, miếng xốp trở nên giòn và cứng hơn, độ đàn hồi giảm, dẫn tới độ bền kéo giảm theo. Do đó nhóm nghiên cứu đã lựa chọn thời gian đông khô là 48 h.
Trên cơ sở kết quả khảo sát nồng độ dung dịch chitosan và thời gian đông khô, tiến hành chế thử xốp cầm máu và dùng sản phẩm này để đánh giá các chỉ tiêu: hình thái lỗ xốp, khả năng thấm hút, thời gian đông máu in vitro và hiệu quả cầm máu trên chuột cống trắng.
3.2. Kết quả kiểm tra hình thái và kích thước lỗ xốp
Kích thước lỗ xốp của miếng xốp cầm máu ảnh hưởng đến khả năng thấm hút, tính chất cơ học và hiệu quả cầm máu của sản phẩm [14]. Hình ảnh SEM được sử dụng để quan sát cấu trúc vi mô của của miếng xốp cầm máu.
Từ Hình 2 có thể thấy mẫu nghiên cứu có cấu trúc xốp khá đồng đều, kích thước các lỗ xốp dao động từ 40 µm - 170 µm. Theo Song và cộng sự, miếng xốp có kích thước lỗ khoảng 200 µm cho thấy tốc độ hấp thụ nước cao, tương đương với các sản phẩm thương mại [14], trong khi đó miếng xốp có kích thước lỗ nhỏ tạo nên cấu trúc dày đặc hơn, cải thiện tính chất cơ lý của miếng xốp [19]. Như vậy mẫu miếng xốp của nghiên cứu có kích thước lỗ xốp tương đối phù hợp với yêu cầu.

3.3. Khả năng thấm hút của miếng xốp
Khả năng thấm hút là một tiêu chí quan trọng để đánh giá chất lượng của một loại xốp cầm máu, nó ảnh hưởng đến khả năng duy trì độ ẩm xung quanh vết thương, hấp thụ máu, làm tập trung hồng cầu, tiểu cầu vào cấu trúc vi mô của xốp, từ đó thúc đẩy quá trình đông máu [1].
Bảng 3. Kết quả đánh giá khả năng thấm hút của miếng xốp
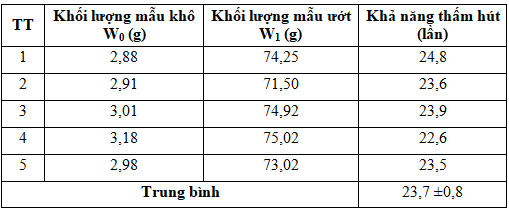
Kết quả khảo sát ở Bảng 3 cho thấy, miếng xốp cầm máu có khả năng thấm hút trung bình khoảng 23 lần khối lượng. Theo các tài liệu xốp chitosan có khả năng thấm hút từ 0,9 lần [14] đến 43 lần khối lượng [20]. Khả năng thấm hút của xốp chitosan bị ảnh hưởng bởi thành phần và phương pháp chế tạo xốp [1]. Nồng độ chitosan thấp thì khả năng thấm hút sẽ cao hơn và ngược lại. Tuy nhiên nồng độ chitosan lại tỉ lệ nghịch với tính chất cơ học của xốp [1, 13]. Trong nghiên cứu này, nồng độ chitosan 3% được lựa chọn để đảm bảo được sự hài hòa giữa tính chất cơ học và khả năng thấm hút của sản phẩm.
3.4. Độ bền kéo của miếng xốp
Yêu cầu của một vật liệu chăm sóc vết thương là có thể bảo vệ hiệu quả vùng bị thương khỏi chấn thương bên ngoài trong khi vẫn duy trì tính toàn vẹn về mặt cấu trúc của sản phẩm [13] do đó độ bền cơ học của xốp cầm máu là một yếu tố quan trọng cần được nghiên cứu. Kết quả đánh giá độ bền kéo của miếng xốp được thể hiện như sau:
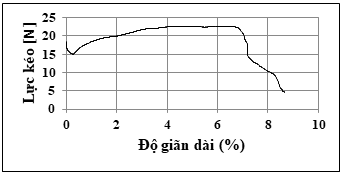
Hình 3. Đồ thị kéo giãn của miếng xốp cầm máu
Từ giản đồ Hình 3 cho thấy khi chịu tác động của lực kéo, miếng xốp có độ đàn hồi và có khả năng duy trì được tính chất cơ lý. Lực kéo đạt mức 23 N đối với miếng xốp có chiều rộng 25 mm, chiều dài 80 mm. Miếng xốp có khả năng giãn 7% mà vẫn giữ được hình dạng và cấu trúc xốp. So sánh với sản phẩm xốp chitosan hiện có trên thị trường (yêu cầu lực kéo ≥ 5 N), miếng xốp nghiên cứu có chất lượng phù hợp để sử dụng thực tế.
3.5. Kết quả đánh giá thời gian đông máu in vitro
Kiểm tra thời gian đông máu in vitro là thử nghiệm đầu tiên để xác định hiệu quả cầm máu của miếng xốp, làm cơ sở để điều chỉnh các yếu tố của quy trình chế tạo sản phẩm. Kết quả thử nghiệm được trình bày ở Bảng 4.

Hình 4. Hình ảnh đánh giá thời gian đông máu in vitro của xốp cầm máu
Bảng 4. Kết quả khảo sát thời gian đông máu in vitro
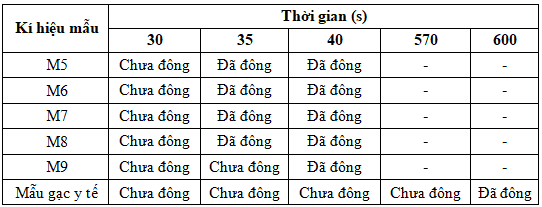
Kết quả nghiên cứu ở Bảng 4 chỉ ra rằng, sau 35 s, các mẫu M5, M6, M7 và M8 đã đông máu hoàn toàn, dung dịch nước muối không chuyển sang màu hồng (Hình 4, Bảng 4). Mẫu M9 đông máu hoàn toàn sau 40 s. Trong khi đó với mẫu sử dụng băng gạc y tế thông thường, ở thời điểm 600 s (10 min) mẫu máu mới đông hoàn toàn. Như vậy, sản phẩm xốp cầm máu của nghiên cứu có thời gian đông máu in vitro ít hơn 15 lần so với với băng gạc y tế thông thường.
3.6. Đánh giá tác dụng cầm máu của chế phẩm trên chuột cống trắng
Kết quả kiểm soát chảy máu ở các lô chuột thí nghiệm được trình bày ở Bảng 5.
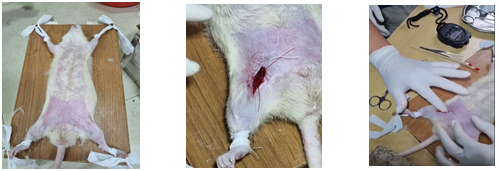
Hình 5. Hình ảnh thử nghiệm tác dụng cầm máu của sản phẩm trên chuột
Bảng 5. Kết quả đánh giá khả năng kiểm soát chảy máu trên chuột
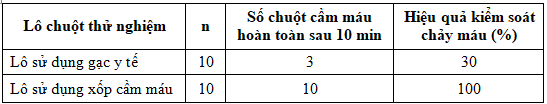
Kết quả cho thấy, sau 10 min, với lô chứng chỉ có 3/10 con chuột cầm máu, hiệu quả kiểm soát chảy máu là 30%. Còn lại 7/10 chuột chảy máu không kiểm soát được (70%). Trong khi đó ở lô nghiên cứu, số chuột cầm máu là 10/10, hiệu quả 100% (đối với mô hình xuất huyết động mạch đùi nông của chuột cống trắng).
Kết quả đánh giá thời gian cầm máu và khối lượng máu mất của chuột ở các lô nghiên cứu (đối với những chuột cầm máu hiệu quả sau 10 min) như sau:
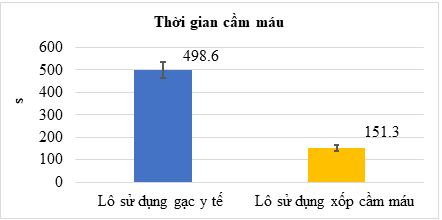
Hình 6. Kết quả đánh giá thời gian cầm máu in vivo của các lô nghiên cứu
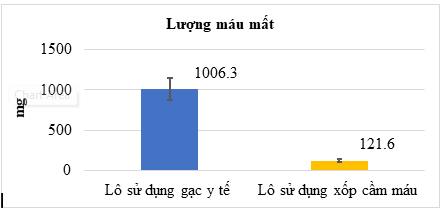
Hình 7. Kết quả đánh giá lượng máu mất của các lô nghiên cứu
Hình 6 và Hình 7 cho thấy, lô sử dụng xốp cầm máu có thời gian cầm máu nhanh hơn 3,3 lần so với lô sử dụng gạc y tế (151,3 s so với 498,6 s), và lượng máu mất ít hơn khoảng 8,5 lần so với lô sử dụng gạc y tế (121,6 mg so với 1006,3 mg), khác biệt có ý nghĩa thống kê (p < 0,01).
4. KẾT LUẬN
Đã chế tạo thành công miếng xốp cầm máu cấu tạo từ chitosan và khảo sát được các tính chất cơ bản của miếng xốp. Miếng xốp có cấu trúc xốp đồng đều, kích thước lỗ xốp dao động từ 40 µm đến 170 µm, có khả năng thấm hút tốt (23 lần khối lượng). Các thử nghiệm đông máu in vitro cho thấy miếng xốp có thời gian làm đông máu nhanh (≤ 40 s). Sản phẩm có hiệu quả tốt trong kiểm soát chảy máu, giúp cầm máu nhanh gấp 3,3 lần và lượng máu mất ít hơn khoảng 8,5 lần so với gạc y tế thông thường trên mô hình chảy máu động mạch đùi của chuột cống trắng.
Như vậy miếng xốp cầm máu sản xuất từ chitosan trong nghiên này có khả năng cầm máu nhanh và hiệu quả. Sản phẩm có thể ứng dụng trong điều kiện chiến tranh, xung đột hoặc thảm họa. Sản phẩm cũng có tiềm năng chế tạo ở dạng KIT dự phòng trong bộ đồ sơ cấp cứu gia đình hoặc các cơ sở y tế.
Tài liệu tham khảo
2. Hong, C., B.D. Olsen, and P.T. Hammond, A review of treatments for non-compressible torso hemorrhage (NCTH) and internal bleeding, Biomaterials, 2022, 283:121432. DOI: 10.1016/j.biomaterials.2022.121432
3. Mecwan, M., et al., Recent advances in biopolymer-based hemostatic materials, Regen. Biomater., 2022, 9:rbac063. DOI: 10.1093/rb/rbac063
4. Baharlouei, P. and A. Rahman, Chitin and chitosan: Prospective biomedical applications in drug delivery, cancer treatment, and wound healing, Mar. Drugs, 2022, 20(7). DOI: 10.3390/md20070460
5. Khan, M.A. and M. Mujahid, A review on recent advances in chitosan based composite for hemostatic dressings, International Journal of Biological Macromolecules, 2019, 124:138-147. DOI: 10.1016/j.ijbiomac.2018.11.045
6. Yu, P. and W. Zhong, Hemostatic materials in wound care, Burns & Trauma, 2021, 9: tkab019. DOI: 10.1093/burnst/tkab019
7. Bennett, B.L. and L. Littlejohn, Review of new topical hemostatic dressings for combat casualty care, Mil. Med., 2014, 179(5):497-514. DOI: 10.7205/MILMED-D-13-00199
8. Hu, Z., et al., Chitosan-based composite materials for prospective hemostatic applications, Marine Drugs, 2018, 16(8):273. DOI: 10.3390/md16080273
9. Pan, M., et al., Porous chitosan microspheres containing zinc ion for enhanced thrombosis and hemostasis, Materials Science and Engineering: C, 2018, 85:27-36. DOI: 10.1016/j.msec.2017.12.015
10. Niimi, Y., et al., Polyurethane foam for skin graft fixation in clinical-relevant ovine burn wound model for wound repair and regeneration research, Regenerative Therapy, 2020, 14:341-343. DOI: 10.1016/J.RETH.2020.04.007
11. Peng, W., et al., Recent progress of collagen, chitosan, alginate and other hydrogels in skin repair and wound dressing applications, International Journal of Biological Macromolecules, 2022, 208:400-408. DOI: 10.1016/j.ijbiomac.2022.03.002
12. Han, F., et al., Preparation, characteristics and assessment of a novel gelatin-chitosan sponge scaffold as skin tissue engineering material, International Journal of Pharmaceutics, 2014, 476(1-2):124-133. DOI: 10.1016/j.ijpharm.2014.09.036
13. Hu, Z., et al., A super hydrophilic and high strength chitosan hemostatic sponge prepared by freeze-drying and alkali treatment for rapid hemostasis, Materials Today Communications, 2024, 39:108855. DOI:10.1016/j.mtcomm.2024.108855
14. Song, H.-F., et al., Preparation of chitosan-based hemostatic sponges by supercritical fluid technology, Materials, 2014, 7(4):2459-2473. DOI:10.3390/ma7042459
15. TCVN I-1:2017 Bộ tiêu chuẩn về phương pháp kiểm nghiệm thuốc, Phụ lục 9.6 Xác định mất khối lượng do làm khô, 2017.
16. ASTM D 882 : 2002, Standard Test Method for Tensile Properties of Thin Plastic Sheeting, 2002. DOI: 10.1520/D0882-12
17. Sabino, R.M. and K.C. Popat, Evaluating whole blood clotting in vitro on biomaterial surfaces, Bio-Protocol., 2020, 10(3):e3505-e3505. DOI: 10.21769/BIOPROTOC.3505
18. Pogorielov, M., et al., Haemostatic chitosan coated gauze: in vitro interaction with human blood and in-vivo effectiveness, Biomaterials Research, 2015, 19(1):22. DOI: 10.1186/S40824-015-0044-0
19. Peng, Deyi, et al, A novel macroporous carboxymethyl chitosan/sodium alginate sponge dressing capable of rapid hemostasis and drug delivery, International Journal of Biological Macromolecules, 2024, 278:134943. DOI: 10.1016/J.IJBIOMAC.2024.134943
20. Fan, X., et al., One-step fabrication of chitosan sponge and its potential for rapid hemostasis in deep trauma, Biomedical Materials, 2020, 16(1):015010. DOI: 10.1088/1748-605X/aba878