SO SÁNH TỶ LỆ TƯƠNG ĐỒNG NỒNG ĐỘ ỨC CHẾ TỐI THIỂU CỦA KHÁNG SINH ĐỐI VỚI VI KHUẨN Pseudomonas aeruginosa VÀ Klebsiella pneumoniae BẰNG PHƯƠNG PHÁP VI PHA LOÃNG VÀ E-TEST
Viện Y sinh Nhiệt đới, Trung tâm Nhiệt đới Việt - Nga
Số 63 Nguyễn Văn Huyên, Nghĩa Đô, Cầu Giấy, Hà Nội
Số điện thoại: 0383079588; Email: viethuongk61@gmail.com
Nội dung chính của bài viết
Tóm tắt (Abstract)
COMPARISON OF SIMILARITY RATIOS OF ANTIBIOTIC MINIMUM INHIBITORY CONCENTRATIONS AGAINST Pseudomonas aeruginosa AND Klebsiella pneumoniae USING MICRODILUTION AND E-TEST METHODS
Hospital-acquired infections caused by Gram-negative bacteria, particularly antibiotic-resistant strains of Pseudomonas aeruginosa and Klebsiella pneumoniae, pose a significant challenge to the healthcare systems. Determining the minimum inhibitory concentration (MIC) before prescribing initial antibiotics is necessary to limit the increasing antibiotic resistance caused by inappropriate antibiotic and treatment dosage selection. In this study, we compared MIC values for meropenem, amikacin, ciprofloxacin, and colistin between the microdilution method and the E-test on 20 strains each of P. aeruginosa and K. pneumoniae. The results revealed MIC similarity rates as follows: meropenem at 90% for P. aeruginosa and 85% for K. pneumoniae; amikacin at 80% for P. aeruginosa and 85% for K. pneumoniae; colistin at 50% for P. aeruginosa and 60% for K. pneumoniae; and ciprofloxacin at 95% for both strains. Ciprofloxacin showed the highest similarity between the two methods, followed by meropenem and amikacin, otherwise, colistin showing the lowest similarity. Given these findings, the microdilution method should be considered the reference standard for accurate MIC determination.
Từ khóa (Keywords)
Pseudomonas aeruginosa, Klebsiella pneumoniae, minimum inhibitory concentration, borth microdilution, E-test, nồng độ ức chế tối thiểu, phương pháp vi pha loãng
Chi tiết bài viết
1. ĐẶT VẤN ĐỀ
Hiện nay, nhiễm khuẩn bệnh viện gây nên bởi các vi khuẩn Gram âm đang là một thách thức lớn cho ngành y tế do nó làm gia tăng tình trạng kháng kháng sinh [1]. Pseudomonas aeruginosa và Klebsiella pneumoniae là các tác nhân chiếm tỷ lệ cao, đặc biệt là tại các đơn vị điều trị tích cực. Những năm qua, tỷ lệ phân lập P. aeruginosa và K. pneumoniae ngày càng tăng và việc điều trị gặp nhiều hạn chế do khó chọn được kháng sinh thích hợp ngay từ ban đầu vì khả năng đề kháng khá cao với các kháng sinh mạnh và phổ rộng [2]. Các kháng sinh còn có thể lựa chọn điều trị P. aeruginosa và K. pneumoniae hiện rất hạn chế, chỉ còn một số kháng sinh như carbapnem, amikacin, quinolon và colistin vẫn còn nhạy cảm; tuy nhiên tỉ lệ đề kháng với các kháng sinh này được báo cáo ngày càng tăng. Hạn chế trong các lựa chọn điều trị càng cho thấy sự cần thiết của việc thực hiện kháng sinh đồ trước khi kê đơn thuốc kháng sinh khởi đầu, đặc biệt là đối với những kháng sinh còn giữ được vai trò trong điều trị P. aeruginosa và K. pneumoniae đa kháng như meropenem, amikacin, ciprofloxacin và colistin. Việc cung cấp một giá trị nồng độ ức chế tối thiểu (MIC-Minimal inhibitory concentration) của những kháng sinh này chính xác sẽ giúp các bác sĩ lâm sàng hiệu chỉnh liều một cách tối ưu, nhờ đó mà người bệnh có cơ hội hồi phục tốt hơn. Hiện nay có nhiều phương pháp khác nhau để xác định nhạy cảm với kháng sinh đã được Viện Tiêu chuẩn lâm sàng và xét nghiệm (CLSI-Clinical and Laboratory Standards Institute) của Hoa Kỳ và Ủy ban về thử nghiệm độ nhạy kháng vi sinh vật của châu Âu (EUCAST-European Committee on Antimicrobial Susceptibility Testing) thẩm định và khuyến cáo sử dụng. Trong đó, thanh kháng sinh đồ định lượng (E-test, Epsilometer test) là phương pháp thường xuyên được thực hiện tại các phòng xét nghiệm vi sinh lâm sàng do thao tác đơn giản và E-test được cố định 15 nồng độ kháng sinh được giảm dần theo bậc hai. Phương pháp vi pha loãng trong môi trường nuôi cấy (BMD-Broth microdilution) có thể điều chỉnh nồng độ kháng sinh sử dụng và được coi là phương pháp tiêu chuẩn xác định MIC [3]. Trong nghiên cứu này, để đối chiếu với khuyến cáo của CLSI và EUCAST về xét nghiệm nhạy cảm, chúng tôi đã so sánh sự tương đồng của giá trị MIC (EA-Essential agreement) đối với các kháng sinh meropenem, amikacin, ciprofloxacin và colistin trên các chủng P. aeruginosa và K. pneumoniae bằng hai phương pháp E-test và BMD.
2. ĐỐI TƯỢNG, VẬT LIỆU VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Đối tượng nghiên cứu
40 chủng vi khuẩn Gram âm gồm 20 chủng P. aeruginosa và 20 chủng K. pneumoniae được Bệnh viện Đa khoa Hà Đông và Bệnh viện Đa khoa tỉnh Hà Giang cung cấp.
2.2. Vật liệu nghiên cứu
Bột kháng sinh meropenem, amikacin, ciprofloxacin, colistin (Sigma, Đức), và chất chỉ thị màu resazurin (Sigma, Đức). Với mỗi lần pha kháng sinh, có sử dụng chủng P. aeruginosa ATCC 27853 để kiểm tra chất lượng.
E-test meropenem, E-test amikacin, E-test ciprofloxacin và E-test colistin (BioMerieux - Pháp). Với mỗi lần thực hiện E-test, có sử dụng chủng chuẩn P. aeruginosa ATCC 27853 để kiểm tra chất lượng.
Môi trường canh thang MHB (Mueller-Hinton broth, Sigma, Đức).
Môi trường thạch MHA (Mueller-Hinton agar, Sigma, Đức)
2.3. Phương pháp nghiên cứu
2.3.1. Xác định MIC bằng phương pháp vi pha loãng (BMD)
Các chủng được xác định giá trị MIC đối với kháng sinh với meropenem, amikacin, ciprofloxacin và colistin bằng phương pháp BMD tuân theo khuyến cáo của CLSI như sau: bột kháng sinh meropenem, amikacin, ciprofloxacin, colistin pha trong nước cất thu được nồng độ 10 mg/mL. Kháng sinh sau khi pha được bảo quản tại -80oC [4]. Kháng sinh được pha loãng bậc 2 trong các vi phiến 96 giếng. Dải nồng độ xét nghiệm là từ 0,125 đến 128 µg/mL đối với meropenem và ciprofloxacin; từ 0,125 đến 128 µg/mL đối với amikacin và từ 0,03 đến 32 µg/mL đối với colistin. Mỗi giếng chứa 10 µl dung dịch kháng sinh cùng với 90 µl huyền dịch có nồng độ vi khuẩn 5×106 CFU/mL và 1 µl dung dịch chất chỉ thị màu resazurin. Thực hiện xét nghiệm cùng với chứng âm (dung dịch vi khuẩn) và chứng dương (môi trường canh thang MHB). Kết quả MIC đối với kháng sinh của vi khuẩn được đọc tại giếng có nồng độ thấp nhất ức chế được sự phát triển của vi khuẩn quan sát bằng mắt thường sau 18-24 giờ ủ ở 37oC.
2.3.2. Xác định MIC bằng E-test
E-test được thực hiện đồng thời cùng phương pháp vi pha loãng từ cùng một huyền dịch vi khuẩn. Mỗi chủng được ria trên một đĩa thạch MHA bằng tăm bông vô trùng và để ở nhiệt độ phòng cho mặt thạch se lại, sau đó đặt dải E-test lên mặt thạch. Kết quả MIC được đọc ở điểm cắt của hình elip với dải E-test 18-24 giờ ủ ở 37oC.
2.3.3. Phiên giải kết quả
Kết quả MIC được phiên giải theo tài liệu hướng dẫn của CLSI [5].
Nghiên cứu này sử dụng BMD là phương pháp tham chiếu. Giá trị MIC bằng E-test được so sánh với MIC thu được bằng BMD để xác định sự tương đồng của giá trị MIC giữa hai phương pháp. Tỷ lệ tương đồng của các giá trị MIC được tính theo hướng dẫn của Cumitech 31A, với chỉ số EA. EA là chỉ số tương đồng của các giá trị MIC nằm trong phạm vi ±1 nồng độ pha loãng giữa phương pháp BMD và E-test [6].

2.4. Xử lý số liệu
Số liệu được lưu trữ và xử lý bằng phần mềm Microsoft Excel 2016. Các giá trị được thể hiện dưới dạng phần trăm.
2.5. Đạo đức nghiên cứu
Nghiên cứu đã được Hội đồng Đạo đức trong nghiên cứu Y sinh học của Trung tâm Nhiệt đới Việt-Nga chấp thuận với mã số 47/2022/VREC tại văn bản số 1717/CN-HĐĐĐ ngày 03/6/2022.
3. KẾT QUẢ VÀ BÀN LUẬN
Kết quả xác định tính nhạy cảm của 20 chủng P. aeruginosa và 20 chủng K. pneumoniae đối với các kháng sinh meropenem, amikacin, ciprofloxacin và colistin bằng phương pháp BMD và E-test được trình bày trong Bảng 1 và Bảng 2.
Bảng 1. Kết quả xác định tính nhạy cảm và MIC50, MIC90 trên 20 chủng P. aeruginosa bằng phương pháp BMD và E-test
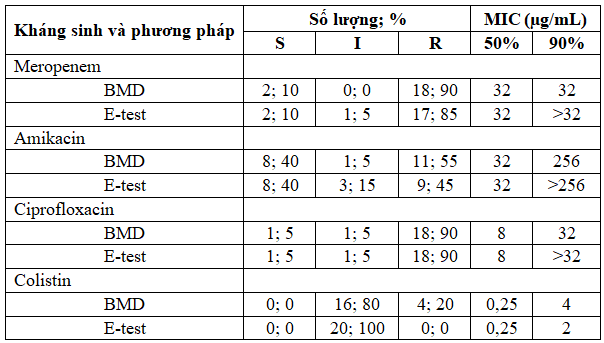
Từ Bảng 1, nhận thấy số chủng P. aeruginosa nhạy cảm (S-Susceptible), kháng trung gian (I-Intermediate) hoặc kháng (R-Resistant) với ciprofloxacin tương đương nhau giữa hai phương pháp. Số chủng kháng với meropenem, amikacin và colistin được phát hiện bẳng E-test thấp hơn so với BMD. Trong nghiên cứu này, giá trị MIC90 của E-test cao hơn BMD đối với meropenem (lần lượt là >32 µg/mL và 32 µg/mL), amikacin (>256 µg/mL và 256 µg/mL) và ciprofloxacin (>32 µg/mL và 32 µg/mL). Tuy nhiên, giá trị MIC90 đối với colistin của E-test thấp hơn BMD (lần lượt là 2 µg/mL và 4 µg/mL). Không quan sát thấy có sự khác biệt về giá trị MIC50 của các kháng sinh khi thực hiện bằng hai phương pháp.
Bảng 2. Kết quả xác định tính nhạy cảm và MIC50, MIC90 trên 20 chủng K. pneumoniae bằng hai phương pháp
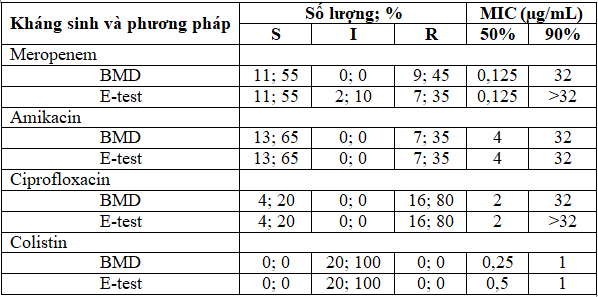
Từ Bảng 2, nhận thấy số chủng K. pneumoniae nhạy cảm, kháng trung gian hoặc kháng với amikacin, ciprofloxacin và colistin tương đương nhau giữa hai phương pháp. Số chủng kháng meropenem được phát hiện bẳng E-test thấp hơn so với BMD. Trong nghiên cứu này, khi thực hiện bằng hai phương pháp, đã không quan sát thấy sự khác biệt về giá trị MIC50 của meropenem, amikacin và ciprofloxacin (lần lượt là 0,125 µg/mL; 4 µg/mL và 2 µg/mL). Giá trị MIC90 của E-test cao hơn BMD đối với meropenem (lần lượt là >32 µg/mL và 32 µg/mL) và ciprofloxacin (>32 µg/mL và 32 µg/mL). Đối với colistin, giá trị MIC50 của E-test cao hơn so với BMD (lần lượt là 0,5 µg/mL và 0,25 µg/mL) và giá trị MIC90 đều cho kết quả là 1 µg/mL.
Nghiên cứu này đã xác định sự tương đồng của giá trị MIC giữa hai phương pháp. Kết quả được trình bày trong Bảng 3.
Bảng 3. Sự tương đồng của giá trị MIC giữa hai phương pháp
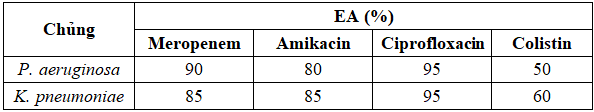
Đối với tất cả các chủng xét nghiệm, kết quả đều cho chỉ số EA giữa hai phương pháp cao nhất đối với ciprofloxacin (95%), tiếp theo là meropenem và amikacin. Ngược lại, EA thấp nhất đối với colistin (50% và 60%).
Hiện nay, meropenem là một trong những kháng sinh dự trữ, đóng vai trò quan trọng trong việc điều trị nhiễm khuẩn bệnh viện do P. aeruginosa và K. pneumoniae trên bệnh nhân nặng. Nghiên cứu của Kiều Thái Bảo Hân và cộng sự năm 2023, cho thấy trong số 19 kháng sinh được sử dụng để điều trị viêm phổi bệnh viện tại bệnh viện Chợ Rẫy, meropenem là một trong những kháng sinh được sử dụng nhiều nhất với tỷ lệ 14,9% [7]. Ngoài ra, meropenem khi phối hợp với colistin hoặc aminoglycosid có thể làm tăng hiệu quả điều trị của một số trường hợp nhiễm khuẩn nặng. Do đó, việc cung cấp giá trị MIC chính xác bằng phương pháp xét nghiệm phù hợp là giải pháp quan trọng giúp giảm đề kháng kháng sinh, đồng thời tối ưu hóa việc sử dụng thuốc trong thực hành lâm sàng. Trong nghiên cứu này, EA của meropenem là 90% đối với P. aeruginosa và 85% đối với K. pneumoniae. Kết quả này tương đồng với nghiên cứu của Maxwell và cộng sự năm 2021 cho tỷ lệ 86% đối với P. aeruginosa; nghiên cứu của Asma và cộng sự năm 2011 là 85% đối với K. pneumoniae [8, 9].
Những năm gần đây, tỉ lệ P. aeruginosa và K. pneumoniae nhạy cảm với carbapenem tại Việt Nam ngày càng giảm. Báo cáo của 16 bệnh viện thuộc Hệ thống giám sát quốc gia năm 2020 về dữ liệu kháng sinh đồ của 69 715 chủng vi khuẩn phân lập được, cho thấy 45,3% chủng P. aeruginosa và gần 50% chủng K. pneumoniae kháng carbapenem [10]. Việc gia tăng các chủng P. aeruginosa và K. pneumoniae kháng carbapenem đã đưa amikacin trở thành một kháng sinh quan trọng trong điều trị vì khả năng diệt khuẩn Gram âm và tác dụng hiệp đồng với nhiều nhóm kháng sinh khác [11]. Kết quả trong nghiên cứu này cho thấy, EA của amikacin đối với P. aeruginosa và K. pneumoniae lần lượt là 80% và 85%.
Ciprofloxacin có hoạt tính mạnh và có phổ kháng khuẩn rộng. Ciprofloxacin có tác dụng tốt với các vi khuẩn Gram âm kháng lại kháng sinh thuộc các nhóm khác (aminoglycosid, cephalosporin, tetracyclin, penicilin...) và được coi là một trong những thuốc có tác dụng mạnh nhất trong nhóm fluoroquinolon [12]. Từ kết quả trong nghiên cứu, nhận thấy EA của ciprofloxacin là 90% đối với cả P. aeruginosa và K. pneumoniae, tương tự, nghiên cứu Mucahide và cộng sự năm 2019 trên vi khuẩn Gram âm (26 chủng P. aeruginosa và 58 chủng K. pneumoniae) cho EA là 94,7% [13].
P. aeruginosa và K. pneumoniae là những tác nhân hàng đầu gây nhiễm khuẩn bệnh viện, hiện đã gia tăng đề kháng với nhiều kháng sinh thông dụng. Khi mà các kháng sinh nhóm beta-lactam, aminoglycosid hoặc quinolon không còn hiệu quả nữa thì kháng sinh nhóm polymyxin đặc biệt là colistin thường được xem là lựa chọn thích hợp. Colistin khi kết hợp với một hoặc vài kháng sinh khác sẽ làm tăng hiệu quả trong điều trị. Tuy nhiên, khi điều trị bằng colistin cho bệnh nhân, thuốc có thể gây độc trên thận, độc tính tăng khi tăng liều colistin tích lũy. Để sử dụng colistin an toàn và hiệu quả, cần chỉ định liều lượng thuốc dựa trên kết quả MIC của xét nghiệm kháng sinh đồ để đảm bảo hoạt tính kháng khuẩn tối đa và độc tính tối thiểu. Do đó, cần tìm ra phương pháp xét nghiệm chính xác và phù hợp trong lâm sàng. Trong nghiên cứu này, EA của colistin là 50% đối với P. aeruginosa và 60% đối với K. pneumoniae. Hơn nữa, số chủng P. aeruginosa có MIC ≤ 2 µg/mL khi thực hiện bằng BMD cao hơn so với E-test. Nghiên cứu của Matuschek và cộng sự năm 2018, cho kết quả EA của colistin chỉ đạt 52% đối với P. aeruginosa và 63% đối với K. pneumoniae; nghiên cứu của Chew và cộng sự năm 2017 cũng chỉ ra số chủng có MIC ≤ 2 µg/mL cao hơn ở BMD [14, 15]. Ngoài ra, đã có rất nhiều nghiên cứu của nước ngoài chỉ ra rằng kỹ thuật E-test không thích hợp để xác định MIC của colistin đối với vi khuẩn Gram âm [15, 16]. CLSI và EUCAST khuyến cáo, chỉ có duy nhất BMD được sử dụng để làm tham chiếu trong xác định MIC của colistin với vi khuẩn.
Nghiên cứu của chúng tôi còn hạn chế về cỡ mẫu, do đó cũng ảnh hưởng đến việc thống kê tỷ lệ EA. Mặc dù vậy, kết quả về chỉ số EA đối với kháng sinh meropenem, amikacin và ciprofloxacin đều có giá trị nằm trong khoảng từ 80% đến 95%, đồng thời cũng cho thấy sự phù hợp với khuyến cáo của CLSI và EUCAST trong việc sử dụng BMD làm phương pháp chuẩn để xác định MIC của colistin.
4. KẾT LUẬN
Trong nghiên cứu này, chúng tôi đã đánh giá tỷ lệ tương đồng của giá trị MIC của P. aeruginosa và K. pneumoniae đối với meropenem, amikacin, ciprofloxacin và colistin bằng BMD và E-test. Kết quả cho thấy EA của kháng sinh ciprofloxacin cao nhất (95% đối với cả P. aeruginosa và K. pneumoniae), tiếp theo là meropenem (90% và 80%) và amikacin (80% và 85%), tỷ lệ thấp nhất đối với colistin (50% và 60%). Nghiên cứu cho thấy sự phù hợp với khuyến cáo của CLSI và EUCAST về xác định MIC của colistin và giúp cán bộ xét nghiệm nâng cao tay nghề trong thực hành.
Tài liệu tham khảo
2. Zhanel G.G, DeCorby M., Laing N., Weshnoweski B., Vashisht R., Tailor F., Nichol K.A., Wierzbowski A., Baudry P.J., Karlowsky J.A., Lagace-Wiens P., Walkty A., McCracken M., Mulvey M.R., Johnson J., Antimicrobial-resistant pathogens in intensive care units in Canada: Results of the Canadian National Intensive Care Unit (CAN-ICU) study 2005-2006, Antimicrobial agents and chemotherapy, 2008, 52(4):1430-1437. DOI: 10.1128/AAC.01538-07
3. Bộ Y tế, Hướng dẫn thực hành kỹ thuật xét nghiệm vi sinh lâm sàng, Nhà xuất bản Y học Hà Nội, 2017.
4. Clinical and Laboratory Standards Institute, Methods for dilution dntimicrobial susceptibility tests for bacteria that grow aerobically, 2015.
5. Clinical and Laboratory Standards Institute, Performance standards for antimicrobial susceptibility testing, 33th ed, 2023.
6. Clark R. B., Lewinski M. A., Loeffelholz M. J., Tibbetts R. J., Cumitech 31 a: verification and validation of procedures in the clinical microbiology laboratory, American Society for Microbiology, 2009.
7. Kiều Thái Bảo Hân, Lưu Gia Linh, Bùi Nguyễn Như Hương, Nguyễn Thị Thu Thủy, Khảo sát thực trạng sử dụng thuốc kháng sinh trong điều trị viêm phổi bệnh viện tại bệnh viện Chợ Rẫy giai đoạn 2021-2022, Tạp chí Y học Việt Nam, 2023, 533(1B):368-371. DOI: 10.51298/vmj.v533i1B.7889
8. Maxwell J. L., Holly K. H., David P. N., Joseph L. K., Contemporary analysis of ETEST for antibiotic susceptibility and minimum inhibitory concentration agreement against Pseudomonas aeruginosa from patients with cystic fibrosis, Clinical microbiology and antimicrobials, 2021, 20(1):9. DOI: 10.1186/s12941-021-00415-0
9. Lat A., Sarah A., Wu F., Whittier S., Della-Latta P., Fauntleroy K., Jenkins, Lisa Saiman S. G., Kubin C. J., Comparison of polymyxin b, tigecycline, cefepime, and meropenem mics for kpc-producing klebsiella pneumoniae by broth Microdilution, Vitek 2, and Etest, Journal of Clinical Microbiology, 2011, 49(5):1795-1798. DOI: 10.1128/JCM.02534-10
10. Bộ Y tế, Báo cáo giám sát kháng kháng sinh tại Việt Nam năm 2020, Hà Nội, 2023, tr. 10-11.
11. Brink A.J., Epidemiology of carbapenemresistant Gram-negative infections globally, Current Opinion in Infectious Diseases, 2019, 32(6):609-616. DOI: 10.1097/QCO.0000000000000608
12. Nguyễn Tứ Sơn, Ứng dụng một số chỉ số PK/KD trong dự báo hiệu quả điều trị nhiễm khuẩn của Ciprofloxacin tại khoa hồi sức tích cực, bệnh viện Bạch Mai, Luận văn thạc sỹ dược học, Trường Đại học Dược Hà Nội, 2011.
13. Mucahide E. K., Ismail D., Rabia G., Melike T., Ferhat Z., Mustafa S., Comparison of conventional methods and automated systems for determining antibiotic susceptibility of bacteria isolated from urine culture, Bangladesh Journal of Medical Science, 2019, 18(3):519-526. DOI: https://doi.org/10.3329/bjms.v18i3.41620
14. Matuschek E., Ahman J., Webster C., Kahlmeter G., Antimicrobial susceptibility testing of colistin e evaluation of seven commercial MIC products against standard broth microdilution for Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa, and Acinetobacter spp., Clinical Microbiology and Infection, 2018, 24:865-870. DOI: 10.1016/j.cmi.2017.11.020
15. Chew K.L., La M.V., Lin R.T.P., Teo J. W. P., Colistin and Polymyxin B susceptibility testing for carbapenem-resistant and mcr-positive enterobacteriaceae: comparison of sensititre, microscan, vitek 2, and etest with broth microdilution, Journal of Clinical Microbiology, 2017, 55(9): 2609-2616. DOI: 10.1128/JCM.00268-17
16. Lo-Ten-Foe J.R., Smet A. M., Diederen B. M. W., Kluytmans J. A. J. W, Keulen P. H. J., Comparative evaluation of the VITEK 2, disk diffusion, E-test, broth microdilution, and agar dilution susceptibility testing methods for colistin in clinical isolates, including heteroresistant Enterobacter cloacae and Acinetobacter baumannii strains, Antimicrobial Agents and Chemotherapy 2007, 51(10):3726-3720. DOI: 10.1128/AAC.01406-06