MỘT SỐ HỢP CHẤT PHÂN LẬP TỪ VI TẢO BIỂN AURANTIOCHYTRIUM SP. SC145
Học viện Khoa học và Công nghệ, Viện Hàn lâm KH&CN Việt Nam, Trung tâm Nhiệt đới Việt - Nga
Học viện Khoa học và Công nghệ, Viện Hàn lâm KH&CN Việt Nam
Số điện thoại: 0987556168; Email: ntthuy.vietnga@gmail.com
Nội dung chính của bài viết
Tóm tắt (Abstract)
ISOLATED COMPOUNDS FROM MARINE MICROALGAE AURANTIOCHYTRIUM SP. SC145
Phytochemical investigation of the marine microalgae Aurantiochytrium sp. SC145 led to the isolation of six known compounds including cyclo-(L-Pro-L-Leu) (1), tyrosyl linoleate (2), (9Z,12Z)-Octadeca-9,12-dienoic acid (3), (S)-2,3-dihydroxypropyl (9Z,12Z)-octadeca-9,12-dienoate (4), cibotiglycerol (5), adenosine (6). Structures of the isolated compounds were elucidated by HRMS and NMR data.
Từ khóa (Keywords)
Aurantiochytrium, cyclo-(L-Pro-L-Leu), tyrosyl linoleate, octadeca-9, 12-dienoic acid, cibotiglycerol, adenosine
Chi tiết bài viết
1. ĐẶT VẤN ĐỀ
Vi tảo là nguồn nguyên liệu tiềm năng để tìm kiếm các hoạt chất có tác dụng sinh học. Aurantiochytrium là một chi gồm các loài vi tảo biển dị dưỡng, thuộc họ Thraustochytridae. Chi Aurantiochytrium đóng vai trò quan trọng trong quá trình lên men sinh khối công nghiệp [1]. Các nghiên cứu trước đây chỉ ra thành phần hóa học của Aurantiochytrium sp. bao gồm nhiều loại acid béo không no như Omega-3,6,9 [2], các squalene như myristic acid, palmitic acid, palmitoleic acid… [3] và một số sterol khác [4]. Các nghiên cứu về hoạt tính sinh học cũng cho thấy cao chiết từ sinh khối của vi tảo Aurantiochytrium có hoạt tính kháng viêm, chống gốc tự do và ức chế enzym Acetylcholinesterase [3]. Nghiên cứu này công bố kết quả phân lập và xác định cấu trúc của sáu hợp chất từ sinh khối của vi tảo biển dị dưỡng Aurantiochytrium sp. SC145.
2. PHƯƠNG PHÁP NGHIÊN CỨU VÀ THỰC NGHIỆM
2.1. Mẫu nghiên cứu
Vi tảo Aurantiochytrium sp. SC145 được thu thập tại đảo Sơn Ca, quần đảo Trường Sa, tỉnh Khánh Hoà vào tháng 5 năm 2021 và được định danh bằng phương pháp giải trình tự gen 18S rRNA và so sánh với dữ liệu trên GenBank [3]. Mẫu được lưu trữ tại Viện Công nghệ sinh học, Viện Hàn lâm Khoa học và Công nghệ Việt Nam (Viện HL KH&CN VN).
2.2. Vật liệu và phương pháp nghiên cứu
Phổ cộng hưởng từ hạt nhân (NMR) được đo trên thiết bị Brucker Avance 600 MHz (chất chuẩn nội tetramethyl sillane - TMS) tại Viện Hóa học, Viện HL KH&CN VN. Phổ khối lượng phân giải cao HR-ESI-MS được đo trên máy AGILENT 6530 Accurate Mass của Viện Hóa sinh biển, Viện HL KH&CN VN.
Sắc ký lớp mỏng được thực hiện trên bản mỏng tráng sẵn DC-Alufolien 60 F254 (Merck) hoặc RP18 F254S (Merck). Vết chất được phát hiện bằng đèn tử ngoại ở hai bước sóng 254 nm và 365 nm hoặc dùng thuốc thử là dung dịch H2SO4 10% được phun đều lên bản mỏng, sấy khô rồi hơ nóng từ từ đến khi hiện màu.
Sắc ký cột: Được tiến hành với các chất hấp phụ là silica gel, pha đảo RP-18, và diaion HP-20. Silica gel có cỡ hạt là 0,040-0,063 mm (240-430 mesh) và pha đảo RP-18 (120 μm, YMC Co. Ltd.).
2.3. Phương pháp nuôi sinh khối
Vi tảo Aurantiochytrium sp. SC145 được nuôi cấy trong máy lên men có dung tích 30L bằng môi trường dinh dưỡng gồm glucose 9%, chiết xuất nấm men công nghiệp 1% và độ mặn 3%. Sinh khối tảo được thu hoạch sau 120 giờ lên men ở nhiệt độ 32-37 ℃ bằng cách ly tâm ở tốc độ 4000 vòng/phút trong 10 phút. Bã tảo được rửa sạch bằng nước cất vô trùng, sau đó sấy khô đến khối lượng không đổi ở 50 ℃, nghiền thành bột và bảo quản trong bình hút ẩm.
2.4. Phân lập các chất
Bột tảo sấy khô (2,2 kg) được chiết trong bể siêu âm với methanol (20 L x 3 lần) ở nhiệt độ phòng trong 24h. Dịch chiết được gom lại và cất loại dung môi ở áp suất giảm thu được 110 g cặn chiết methanol. Cặn chiết này sau đó được phân bố trong 1,5 L nước cất và chiết phân lớp với diclomethan (1,5 L × 3 lần). Pha hữu cơ được thu lại và cất loại dung môi để thu được cặn chiết diclomethan (AS, 35 g). Cặn chiết AS được phân tách trên cột silica gel với hệ dung môi rửa giải n-hexan:aceton (gradient 40:1, 20:1, 10:1, 5:1, 2,5:1, 1:1, v/v) thu được 5 phân đoạn AS1A (7,5 g), AS1B (3,1 g), AS1C (5,4 g), AS1D (5,8 g) và AS1E (6,4 g).
Phân đoạn AS1B được phân tách trên cột silica gel và rửa giải với hệ dung môi n-hexan:aceton (6:1, v/v) thu được 5 phân đoạn AS1B2A (130 mg), AS1B2B (864 mg), AS1B2C (986 mg), AS1B2D (172 mg) và AS1B2E (317 mg). Phân đoạn AS1B2E được phân tách trên cột RP-18 cùng với hệ dung môi MeOH:H2O (4:1, v/v) rửa giải, thu được 3 phân đoạn AS1B2E1 (50 mg), AS1B2E2 (100 mg) và AS1B2E3 (30 mg). Phân đoạn AS1B2E2 được phân tách trên hệ thống HPLC sử dụng pha động 40% acetonitril trong nước, thu được hợp chất là 1 (1,4 mg, tR 19,9 min). Phân đoạn AS1B2B được phân tách trên cột silica gel và rửa giải bằng hệ dung môi n-hexan:EtOAc (2:1, v/v) thu được 2 phân đoạn AS1B2B1 (300 mg) và AS1B2B2 (250 mg). Phân đoạn AS1B2B1 tiếp tục phân tách trên hệ thống HPLC, pha động 98% acetonitril trong nước, thu được 1 hợp chất 2 (26,1 mg, tR 50,6 min). Phân đoạn AS1B2A tiếp tục phân tách tiếp trên cột silica gel sử dụng hệ dung môi n-hexan:EtOAc (3:1, v/v) thu được 2 phân đoạn AS1B2A1 (40 mg) và AS1B2A2 (45 mg). Phân đoạn AS1B2A1tiếp tục phân tách trên hệ thống HPLC, pha động 98% acetonitril trong nước, thu được hợp chất 3 (18,7 mg, tR 55,2 min). Phân đoạn AS1B2D được phân tách trên cột RP-18 và sử dụng hệ dung môi acetone:H2O (4,5:1, v/v) để rửa giải, thu được 2 phân đoạn AS1B2D1 (70 mg) và AS1B2D2 (40 mg). Phân đoạn AS1B2D2 tiếp tục được phân tách bằng cột RP-18 với hệ dung môi rửa giải aceton:H2O (4,5:1, v/v) thu được 1 hợp chất 4 (7,5 mg). Phân đoạn AS1D được phân tách trên cột RP-18 với hệ dung môi rửa giải aceton:H2O (1:1, v/v) thu được 4 phân đọan AS1D1 (3.8 g), AS1D2 (350 mg), AS1D3 (790 mg) và AS1D4 (561 mg). Phân đoạn AS1D4 được phân tách trên cột silica gel sử dụng hệ dung môi rửa giải dichloromethane:acetone: H2O (1:5:0.3, v/v/v) thu được 3 phân đoạn AS1D4A (100 mg), AS1D4B (95 mg) và AS1D4C (120 mg). Phân đoạn AS1D4A tiếp tục được phân tách trên cột RP-18 sử dụng hệ dung môi rửa giải MeOH:H2O (4:1, v/v) thu được hợp chất là 5 (6,8 mg). Phân đoạn AS1D2 tiếp tục được phân tách trên cột silica gel và sử dụng hệ dung môi n-hexan:aceton (4:1, v/v) rửa giải, thu được 3 phân đoạn AS1D2A (35 mg), AS1D2B (50 mg) và AS1D2C (30 mg). Phân đoạn AS1D2A tiếp tục được phân tách trên hệ thống HPLC, pha động 35-55% MeOH trong nước thu được hợp chất 6 (5 mg, tR 27,6 phút).
Cyclo-(L-Pro-L-Leu) (1): Chất bột màu trắng, vô định hình. Công thức phân tử: C11H18O3N2. Khối lượng phân tử: 210,3. ESI-MS m/z 211 [M+H]+. UV (MeOH) λmax 220, 280 nm. Độ quay cực :![]() -57,6 (c=0,1, CHCl3). (
-57,6 (c=0,1, CHCl3). (![]() :-133 (c=0,3; ethanol). IR (KBr) νmax 3259, 2921, 1668, 1633, 1433 cm-1. Số liệu phổ 1H-NMR (CDCl3): δH (ppm) 3,55 (1H; m; H-3a); 3,60 (1H; m; H-3b); 2,07 (1H; m; H-4); 1,90 (1H; m; H-4); 2,36 (2H; m; H-5); 4,12 (1H; dd; J = 7,8; 7,8 Hz; H-6); 4,02 (1H; dd; J = 3,6; 9,6 Hz; H-9); 1,52 (1H; m; H-10); 2,07 (1H; m; H-10); 1,74 (1H; m; H-11); 0,96 (3H; d; J = 6,6 Hz; H-12); 1,00 (3H; d; J = 6,6 Hz; H-13). 13C-NMR (CDCl3): δC (ppm) 166,1 (C-1); 45,5 (C-3); 22,7 (C-4); 28,1 (C-5); 59,0 (C-6); 170,2 (C-7); 53,4 (C-9); 38,7 (C-10); 24,7 (C-11); 21,2 (C-12); 23,3 (C-13).
:-133 (c=0,3; ethanol). IR (KBr) νmax 3259, 2921, 1668, 1633, 1433 cm-1. Số liệu phổ 1H-NMR (CDCl3): δH (ppm) 3,55 (1H; m; H-3a); 3,60 (1H; m; H-3b); 2,07 (1H; m; H-4); 1,90 (1H; m; H-4); 2,36 (2H; m; H-5); 4,12 (1H; dd; J = 7,8; 7,8 Hz; H-6); 4,02 (1H; dd; J = 3,6; 9,6 Hz; H-9); 1,52 (1H; m; H-10); 2,07 (1H; m; H-10); 1,74 (1H; m; H-11); 0,96 (3H; d; J = 6,6 Hz; H-12); 1,00 (3H; d; J = 6,6 Hz; H-13). 13C-NMR (CDCl3): δC (ppm) 166,1 (C-1); 45,5 (C-3); 22,7 (C-4); 28,1 (C-5); 59,0 (C-6); 170,2 (C-7); 53,4 (C-9); 38,7 (C-10); 24,7 (C-11); 21,2 (C-12); 23,3 (C-13).
(9Z,12Z)-Octadeca-9,12-dienoic acid (2): Chất bột màu trắng, vô định hình. Công thức phân tử: C18H32O2. Khối lượng phân tử: 280,5. ESI-MS m/z 279 [M-H]-; IR (KBr) νmax 3418, 2927, 1712, 1462, 1184 cm-1. Số liệu phổ 1H-NMR (CDCl3): δH (ppm) 2,34 (2H; t; J = 6,6 Hz; H-2); 1,63 (2H; m; H-3); 1,26 (2H; m; H-4); 1,28 (2H; m; H-5); 1,34 (2H; m; H-6); 1,30 (2H; m; H-7); 2,05 (4H; q; J = 6,6 Hz; H-8, H-14); 5,32 (2H; m; H-9, H-13); 5,38 (1H; m; H-10, H-12); 2,77 (2H; t; J = 6,6 Hz; H-11); 1,28 (2H; m; H-15); 1,28 (2H; m; H-16); 1,30 (2H; m; H-17); 0,89 (3H; t; J = 6,6 Hz; H-18). 13C-NMR (CDCl3): δC (ppm) 180,0 (C-1); 34,1 (C-2); 29,7 (C-3); 29,0 (C-4); 29,1 (C-5); 29,1 (C-6); 29,3 (C-7); 27,2 (C-8); 130,2 (C-9); 128,1 (C-10); 25,6 (C-11); 127,9 (C-12); 130 (C-13); 27,2 (C-14); 29,6 (C-15); 31,5 (C-16); 22,6 (C-17); 14,0 (C-18).
Tyrosyl linoleat (3): Chất bột màu trắng, vô định hình. Công thức phân tử: C26H40O3. Khối lượng phân tử: 400,6. UV (MeOH) λmax 228, 278 nm. Độ quay cực ![]() : -92,0 (c=0,1, CHCl3). IR (KBr) νmax 3426, 2923, 1732, 1515, 1168 cm-1. HR-ESI-MS m/z 399,2902 [M‒H]‒. Tính toán lý thuyết cho công thức [C26H39O3] ‒, 399,2905. Số liệu phổ 1H-NMR (CDCl3): δH (ppm) 2,29 (2H; t;J = 7,2 Hz; H-2); 1,64 (2H; m, H-3); 1,34 (2H; m; H-4); 1,29 (2H; m; H-5); 1,32 (2H; m; H-6); 1,35 (2H; m; H-7); 2,05 (4H; q;J = 7,2 Hz, H-8, H-14); 5,31 (1H; m; H-9, H-13); 5,41 (1H; m; H-10, H-12); 2,77 (2H; t; J = 7,2 Hz; H-11); 1,30 (2H; m, H-15); 1,30 (2H; m, H-16); 1,32 (2H; m, H-17); 0,89 (3H; t, J = 6,6 Hz, H-18); 4,24 (2H; t;J = 7,2 Hz; H-1′); 2,85 (2H; t; J = 7,2 Hz; H-2′); 7,07 (2H; d; J = 8,4 Hz; H-4′, H-8′); 6,77 (2H; d;J = 8,4 Hz; H-5′, H-7′). 13C-NMR (CDCl3): δC (ppm) 173,9 (C-1); 34,4 (C-2); 24,9 (C-3); 29,1 (C-4); 29,3 (C-5); 29,2 (C-6); 29,1 (C-7); 27,2 (C-8); 130,2 (C-9); 128,1 (C-10); 25,6 (C-11); 127,9 (C-12); 130,0 (C-13); 27,2 (C-14); 29,1 (C-15); 31,5 (C-16); 22,6 (C-17); 14,1 (C-18); 65,0 (C-1′); 34,3 (C-2′); 127,8 (C-3′); 130,1 (C-4′); 115,4 (C-5′); 154,4 (C-6′); 115,4 (C-7′); 130,1 (C-8′).
: -92,0 (c=0,1, CHCl3). IR (KBr) νmax 3426, 2923, 1732, 1515, 1168 cm-1. HR-ESI-MS m/z 399,2902 [M‒H]‒. Tính toán lý thuyết cho công thức [C26H39O3] ‒, 399,2905. Số liệu phổ 1H-NMR (CDCl3): δH (ppm) 2,29 (2H; t;J = 7,2 Hz; H-2); 1,64 (2H; m, H-3); 1,34 (2H; m; H-4); 1,29 (2H; m; H-5); 1,32 (2H; m; H-6); 1,35 (2H; m; H-7); 2,05 (4H; q;J = 7,2 Hz, H-8, H-14); 5,31 (1H; m; H-9, H-13); 5,41 (1H; m; H-10, H-12); 2,77 (2H; t; J = 7,2 Hz; H-11); 1,30 (2H; m, H-15); 1,30 (2H; m, H-16); 1,32 (2H; m, H-17); 0,89 (3H; t, J = 6,6 Hz, H-18); 4,24 (2H; t;J = 7,2 Hz; H-1′); 2,85 (2H; t; J = 7,2 Hz; H-2′); 7,07 (2H; d; J = 8,4 Hz; H-4′, H-8′); 6,77 (2H; d;J = 8,4 Hz; H-5′, H-7′). 13C-NMR (CDCl3): δC (ppm) 173,9 (C-1); 34,4 (C-2); 24,9 (C-3); 29,1 (C-4); 29,3 (C-5); 29,2 (C-6); 29,1 (C-7); 27,2 (C-8); 130,2 (C-9); 128,1 (C-10); 25,6 (C-11); 127,9 (C-12); 130,0 (C-13); 27,2 (C-14); 29,1 (C-15); 31,5 (C-16); 22,6 (C-17); 14,1 (C-18); 65,0 (C-1′); 34,3 (C-2′); 127,8 (C-3′); 130,1 (C-4′); 115,4 (C-5′); 154,4 (C-6′); 115,4 (C-7′); 130,1 (C-8′).
(S)-2,3-dihydroxypropyl (9Z,12Z)-octadeca-9,12-dienoat (4): Chất bột màu trắng, vô định hình. Công thức phân tử: C21H38O4. Khối lượng phân tử: 354,5. Độ quay cực ![]() : -15,0 (c=0,1, CHCl3). IR (KBr) νmax 3440, 2920, 1730, 1462, 735 cm-1. HR-ESI-MS m/z 355,2830 [M+Na]+ (Tính toán lý thuyết cho công thức [C21H39O4]+, 355,2843). Số liệu phổ 1H-NMR (CDCl3): δH (ppm) 2,35 (2H; t; J = 7,2 Hz; H-2); 1,63 (2H; m; H-3); 1,25 (2H; m; H-4); 1,35 (2H; m; H-5); 1,30 (2H; m; H-6); 1,30 (2H; m; H-7); 2,05 (4H; q; J = 6,6 Hz; H-8, H-14); 5,37 (4H; m; H-9, H-10, H-12, H-13); 1,25 (2H; m; H-15); 1,35 (2H; m; H-16); 1,30 (2H; m; H-17); 0,89 (3H; t; J = 6,6 Hz; H-18); 4,15 (2H; dd; J = 6,6; 12,0 Hz; H-1′); 4,20 (1H; dd; J = 4,8; 12,0; H-1′); 3,95 (1H; m; H-2′); 3,70 (1H; dd; J = 4,8; 11,4 Hz; H-3′); 3,60 (1H; dd; J = 6,0; 11,4 Hz; H-3′). 13C-NMR (CDCl3): δC (ppm) 174,3 (C-1); 34,1 (C-2); 25,0 (C-3); 29,6 (C-4); 29,3 (C-5); 29,1 (C-6); 29,1 (C-7); 27,2 (C-8); 130,2 (C-9); 128,1 (C-10); 25,6 (C-11); 128,1 (C-12); 130,0 (C-13); 27,2 (C-14); 29,1 (C-15); 31,5 (C-16); 22,6 (C-17); 14,1 (C-18); 70,3 (C-1′); 65,2 (C-2′); 63,4 (C-3′).
: -15,0 (c=0,1, CHCl3). IR (KBr) νmax 3440, 2920, 1730, 1462, 735 cm-1. HR-ESI-MS m/z 355,2830 [M+Na]+ (Tính toán lý thuyết cho công thức [C21H39O4]+, 355,2843). Số liệu phổ 1H-NMR (CDCl3): δH (ppm) 2,35 (2H; t; J = 7,2 Hz; H-2); 1,63 (2H; m; H-3); 1,25 (2H; m; H-4); 1,35 (2H; m; H-5); 1,30 (2H; m; H-6); 1,30 (2H; m; H-7); 2,05 (4H; q; J = 6,6 Hz; H-8, H-14); 5,37 (4H; m; H-9, H-10, H-12, H-13); 1,25 (2H; m; H-15); 1,35 (2H; m; H-16); 1,30 (2H; m; H-17); 0,89 (3H; t; J = 6,6 Hz; H-18); 4,15 (2H; dd; J = 6,6; 12,0 Hz; H-1′); 4,20 (1H; dd; J = 4,8; 12,0; H-1′); 3,95 (1H; m; H-2′); 3,70 (1H; dd; J = 4,8; 11,4 Hz; H-3′); 3,60 (1H; dd; J = 6,0; 11,4 Hz; H-3′). 13C-NMR (CDCl3): δC (ppm) 174,3 (C-1); 34,1 (C-2); 25,0 (C-3); 29,6 (C-4); 29,3 (C-5); 29,1 (C-6); 29,1 (C-7); 27,2 (C-8); 130,2 (C-9); 128,1 (C-10); 25,6 (C-11); 128,1 (C-12); 130,0 (C-13); 27,2 (C-14); 29,1 (C-15); 31,5 (C-16); 22,6 (C-17); 14,1 (C-18); 70,3 (C-1′); 65,2 (C-2′); 63,4 (C-3′).
Cibotiglycerol (5): Chất bột màu trắng, vô định hình. Công thức phân tử: C27H48O11S. Khối lượng phân tử: 580.7. Độ quay cực![]() : -15.0 (c=0,1, CHCl3). Độ quay cực
: -15.0 (c=0,1, CHCl3). Độ quay cực![]() : -120,1 (c=0.1, CHCl3). IR (KBr) νmax 3432, 2921, 1732, 1170, 749 cm-1. HR-ESI-MS m/z 603.2755 [M+Na]+. Tính toán lý thuyết cho công thức [C27H48O11SNa]+, 603,2810. 1H-NMR (CDCl3): δH (ppm) 2,39 (2H; t; J = 7,0 Hz; H-2); 1,64 (2H; m; H-3); 1,36 (2H; m; H-4); 1,35 (2H; m; H-5); 1,35 (2H; m; H-6); 1,35 (2H; m; H-7); 2,09 (2H; q; J = 7,0 Hz; H-8); 5,30 (2H; m; H-9; H-13); 5,40 (2H; m; H-10; H-12); 2,77 (2H; t; J = 7,0 Hz; H-11);2,09 (2H; t; J = 7,0 Hz; H-14); 1,35 (2H; m; H-15); 1,32 (2H; m; H-16); 1,35 (2H; m; H-17); 0,92 (3H; t; J = 6,6 Hz; H-18); 4,08 (1H; dd; J = 3,0; 10,2 Hz; H-1′); 3,42 (1H; dd; J = 6,0; 10,2 Hz; H-1′); 4,10 (1H; m; H-2′); 4,22 (1H; dd; J = 6,6; 12,0 Hz; H-3′); 4,12 (1H; dd; J = 3,0; 12,0 Hz; H-3′); 4,80 (1H; dd; J = 3,6 Hz; H-1′′); 3,42 (1H; m; H-2′′); 3,67 (1H; dd; J = 9,6; 9,6 Hz; H-3′′); 3,11 (1H; dd; J = 9,6; 9,6 Hz; H-4′′); 4,1 (1H; m; H-5′′); 2,94 (1H; dd; J = 9,0; 14,4 Hz; H-6′′); 3,37 (1H; dd; J = 1,8; 14,4 Hz; H-6′′). 13C-NMR (CD3OD): δC (ppm) 175,6 (C-1); 34,9 (C-2); 26,0 (C-3); 30,3 (C-4); 30,5 (C-5); 30,7 (C-6); 30,2 (C-7); 28,1 (C-8); 130,9 (C-9, C-13); 129,1 (C-10, C-12); 26,5 (C-11); 28,2 (C-14); 30,2 (C-15); 32,6 (C-16); 23,6 (C-17); 14,4 (C-18); 70,6 (C-1′); 69,8 (C-2′); 66,5 (C-3′); 100,2 (C-1′′); 73,7 (C-2′′); 75,1 (C-3′′); 74,9 (C-4′′); 69,8 (C-5′′); 54,3 (C-6′′).
: -120,1 (c=0.1, CHCl3). IR (KBr) νmax 3432, 2921, 1732, 1170, 749 cm-1. HR-ESI-MS m/z 603.2755 [M+Na]+. Tính toán lý thuyết cho công thức [C27H48O11SNa]+, 603,2810. 1H-NMR (CDCl3): δH (ppm) 2,39 (2H; t; J = 7,0 Hz; H-2); 1,64 (2H; m; H-3); 1,36 (2H; m; H-4); 1,35 (2H; m; H-5); 1,35 (2H; m; H-6); 1,35 (2H; m; H-7); 2,09 (2H; q; J = 7,0 Hz; H-8); 5,30 (2H; m; H-9; H-13); 5,40 (2H; m; H-10; H-12); 2,77 (2H; t; J = 7,0 Hz; H-11);2,09 (2H; t; J = 7,0 Hz; H-14); 1,35 (2H; m; H-15); 1,32 (2H; m; H-16); 1,35 (2H; m; H-17); 0,92 (3H; t; J = 6,6 Hz; H-18); 4,08 (1H; dd; J = 3,0; 10,2 Hz; H-1′); 3,42 (1H; dd; J = 6,0; 10,2 Hz; H-1′); 4,10 (1H; m; H-2′); 4,22 (1H; dd; J = 6,6; 12,0 Hz; H-3′); 4,12 (1H; dd; J = 3,0; 12,0 Hz; H-3′); 4,80 (1H; dd; J = 3,6 Hz; H-1′′); 3,42 (1H; m; H-2′′); 3,67 (1H; dd; J = 9,6; 9,6 Hz; H-3′′); 3,11 (1H; dd; J = 9,6; 9,6 Hz; H-4′′); 4,1 (1H; m; H-5′′); 2,94 (1H; dd; J = 9,0; 14,4 Hz; H-6′′); 3,37 (1H; dd; J = 1,8; 14,4 Hz; H-6′′). 13C-NMR (CD3OD): δC (ppm) 175,6 (C-1); 34,9 (C-2); 26,0 (C-3); 30,3 (C-4); 30,5 (C-5); 30,7 (C-6); 30,2 (C-7); 28,1 (C-8); 130,9 (C-9, C-13); 129,1 (C-10, C-12); 26,5 (C-11); 28,2 (C-14); 30,2 (C-15); 32,6 (C-16); 23,6 (C-17); 14,4 (C-18); 70,6 (C-1′); 69,8 (C-2′); 66,5 (C-3′); 100,2 (C-1′′); 73,7 (C-2′′); 75,1 (C-3′′); 74,9 (C-4′′); 69,8 (C-5′′); 54,3 (C-6′′).
Adenosin (6): Chất bột màu trắng, vô định hình. Công thức phân tử: C10H13N5O4. Khối lượng phân tử: 267,2. UV (MeOH) λmax 258 nm. Độ quay cực ![]() : -60,0 (c=0.1, H2O). HR-ESI-MS m/z 268,1042 [M+H]+. Tính toán lý thuyết cho công thức [C10H14N5O4]+, 268,1040. 1H-NMR (DMSO-d6): δH (ppm) 8,16 (1H; s; H-2); 8,35 (1H; s; H-8); 5,91 (1H; d; J = 6,5 Hz; H-1'); 4,63 (1H; t; J = 6,0 Hz; H-2'); 4,16 (1H; dd; J = 3,0; 5,0 Hz; H-3'); 3,98 (1H; dd; J = 3,6; 6,0 Hz; H-4'); 3,68 (1H; br d; J = 12,0 Hz H-5'a); 3,57 (1H; br d; J = 12,0 Hz; H-5'b); 7,38 (2H; br s; 6-NH2); 5,48 (1H; br d; J = 7,2 Hz; 2′-OH); 5,20 (1H; br d; J = 7,2 Hz; 3′-OH); 5,43 (1H, br t, J = 4,8 Hz; 5′-OH). 13C-NMR (DMSO-d6): δC (ppm) 152,0 (C-2); 149,1 (C-4); 119,9 (C-5); 156,0 (C-6); 139,9 (C-8); 87,9 (C-1'); 73,4 (C-2'); 70,6 (C-3′); 85,8 (C-4′); 61,6 (C-5′).
: -60,0 (c=0.1, H2O). HR-ESI-MS m/z 268,1042 [M+H]+. Tính toán lý thuyết cho công thức [C10H14N5O4]+, 268,1040. 1H-NMR (DMSO-d6): δH (ppm) 8,16 (1H; s; H-2); 8,35 (1H; s; H-8); 5,91 (1H; d; J = 6,5 Hz; H-1'); 4,63 (1H; t; J = 6,0 Hz; H-2'); 4,16 (1H; dd; J = 3,0; 5,0 Hz; H-3'); 3,98 (1H; dd; J = 3,6; 6,0 Hz; H-4'); 3,68 (1H; br d; J = 12,0 Hz H-5'a); 3,57 (1H; br d; J = 12,0 Hz; H-5'b); 7,38 (2H; br s; 6-NH2); 5,48 (1H; br d; J = 7,2 Hz; 2′-OH); 5,20 (1H; br d; J = 7,2 Hz; 3′-OH); 5,43 (1H, br t, J = 4,8 Hz; 5′-OH). 13C-NMR (DMSO-d6): δC (ppm) 152,0 (C-2); 149,1 (C-4); 119,9 (C-5); 156,0 (C-6); 139,9 (C-8); 87,9 (C-1'); 73,4 (C-2'); 70,6 (C-3′); 85,8 (C-4′); 61,6 (C-5′).
3. KẾT QUẢ VÀ THẢO LUẬN
Hợp chất 1 thu được dưới dạng chất rắn màu trắng. Phổ ESI-MS xuất hiện tín hiệu m/z 211 [M+H]+ cho phép xác định khối lượng phân tử của 1 là 210 Da, tương ứng với công thức phân tử C11H18O3N2. Phổ 1H-NMR của hợp chất 1 xuất hiện hai tín hiệu methyl ở δH 0,96 (3H; d; J = 6,6 Hz; H-12); 1,00 (3H; d; J = 6,6 Hz; H-13), hai nhóm methin sp3 gắn với nitơ ở δH 4,12 (1H; dd; J = 7,8; 7,8 Hz; H-6); 4,02 (1H; dd; J = 3,6; 9,6 Hz; H-9), một nhóm methylene gắn với nitơ ở δH 3,55 (1H; m; H-3a). Phổ 13C-NMR xuất hiện tín hiệu của 13 carbon, trong đó, cấu trúc dipeptide được xác định bởi tín hiệu của 2 nhóm amid carbonyl CONH (δC 166,1 C-1 và δC 170,2 C-7). So sánh số liệu phổ NMR với tài liệu tham khảo cho phép xác định cấu trúc của 1 là cyclo-(L-Pro-L-Leu) [5].
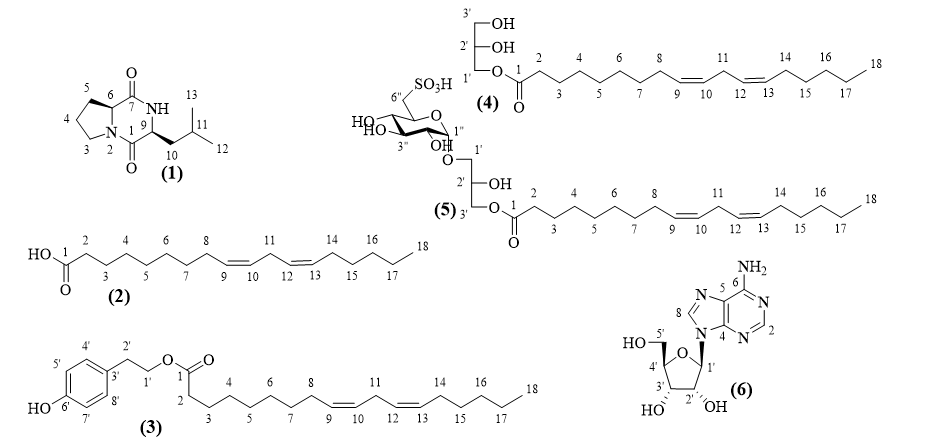
Hình 1. Cấu trúc hoá học của các hợp chất 1-6
Hợp chất 2 thu được dưới dạng dầu. Phổ ESI-MS của hợp chất 2 xuất hiện tín hiệu m/z 279 [M-H]- cho phép xác định khối lượng phân tử 278 Da của 2. Phổ 1H-NMR của 2 có các tín hiệu đặc trưng cho một hợp chất acid béo không no chứa hai liên kết đôi gồm một nhóm methyl đầu mạch xuất hiện dưới dạng triplet tại δH0,89 (3H; t; J = 6,6 Hz; H-18), hai nhóm methylen xuất hiện dưới dạng quintet tại δH); 2,05 (4H; q; J = 6,6 Hz; H-8, H-14), hai nhóm methylen xuất hiện dưới dạng triplet tại δH2,77 (2H; t; J = 6,6 Hz; H-11), 2,34 (2H; t; J = 6,6 Hz; H-2) trong đó 1 nhóm methylen gắn với nhóm carboxyl (-COOH) cộng hưởng .Tín hiệu của bốn proton dạng olefin xuất hiện dưới dạng multiplet tại δH 5,32, 5,38 (4H, m). Ngoài ra còn có tín hiệu của các nhóm methylen chồng chéo lên nhau tại vùng trường cao δH 1,25-1,32. Phổ 13C-NMR có tín hiệu cộng hưởng của 18 nguyên tử cacbon trong đó có một nhóm methyl (δC 14,0, C-18), 4 nhóm methin dạng olefin (δC 130,2 (C-9) và 128,1 (C-10), 127,9 (C-12) và 130,0 (C-13)), một nhóm carboxyl (δC 180,00 (C-1)), và 12 nhóm methylen. Hai nối đôi của chất 2 được xác định cấu hình Z dựa trên độ dịch chuyển của các carbon kế tiếp C-11 (δC 25,6) và C-14 (δC 27,2). Qua các phân tích trên, kết hợp với các dữ liệu đã được công bố, cấu trúc hóa học của 2 được xác định là (9Z,12Z)-octadeca-9,12-dienoic acid [6]
Hợp chất 3 thu được dưới dạng bột màu trắng, vô định hình. Công thức phân tử là C26H40O3, dựa trên phổ HR-ESI-MS tại m/z 399,2902 [M‒H]‒ (Tính toán lý thuyết cho công thức [C26H39O3] ‒, 399,2905). Phổ 1H-NMR của 3 có các tín hiệu đặc trưng của tiểu phân tyrosyl bao gồm δH 4,24 (2H; t; J = 7,2 Hz; H-1′), 2,85 (2H; t; J = 7,2 Hz; H-2′), 7,07 (2H; d; J = 8,4 Hz; H-4′, H-8′), 6,77 (2H; d; J = 8,4 Hz; H-5′, H-7′), cùng với các tín hiệu đặc trưng cho một acid béo không no chứa hai liên kết đôi tương tự như hợp chất 2. Phổ 13C-NMR cũng xuất hiện các tín hiệu đặc trưng cho tiểu phân tyrosyl tại δC 65,0 (C-1′), 34,3 (C-2′), 127,8 (C-3′), 130,1 (C-4′), 115,4 (C-5′), 154,4 (C-6′), 115,4 (C-7′), 130,1 (C-8′) cũng như các tín hiệu của một đơn vị octadeca-9,12-dienoic acid tương tự hợp chất 2. So sánh số liệu phổ NMR của hợp chất 3 và so sánh với tài liệu tham khảo cho phép xác định cấu trúc của hợp chất này là tyrosyl linoleat [7].
Hợp chất 4 thu được dưới dạng dầu. Công thức phân tử là C21H38O4, dựa trên phổ HR-ESI-MS tại m/z 355,2830 [M+H]+ (Tính toán lý thuyết cho công thức [C21H38O4Na]+, 355,2843). Phổ 1H-NMR của 4 có các tín hiệu đặc trưng cho một hợp chất triglycerid este tại δH 4,15 (2H; dd; J = 6,6; 12,0 Hz; H-1′), 4,20 (1H; dd; J = 4,8; 12,0; H-1′), 3,95 (1H; m; H-2′), 3,70 (1H; dd; J = 4,8; 11,4 Hz; H-3′), 3,60 (1H; dd; J = 6,0; 11,4 Hz; H-3′) cùng với các tín hiệu đặc trưng của đơn vị octadeca-9,12-dienoic acid tương tự hợp chất 2. Phổ 13C-NMR có tín hiệu cộng hưởng của 18 nguyên tử carbon đặc trưng cho dẫn xuất của hợp chất octadeca-9,12-dienoic acid tương tự như hợp chất 2 cùng với 3 tín hiệu carbon có chứa oxy thuộc nhóm rượu glycerol tại δC 70,3 (C-1′), 65,2 (C-2′), 63,4 (C-3′). Qua các phân tích trên, so sánh với dữ liệu đã được công bố, cấu trúc hóa học của 4 được xác định là (S)-2,3-dihydroxypropyl (9Z,12Z)-octadeca-9,12-dienoat [8].
Hợp chất 5 thu được dưới dạng bột màu trắng, vô định hình. Công thức phân tử là C27H48O11S, dựa trên phổ HR-ESI-MS tại m/z 603,2755 [M+Na]+ (Tính toán lý thuyết cho công thức [C27H48O11SNa]+, 603,2810). Phổ 1H-NMR và 13C-NMR khẳng định sự xuất hiện của 1 nhóm đường và gốc este của 1 acid béo không no (glycoglycerolipid), trong đó, các tín hiệu phổ tương tự với hợp chất 2 cho phép xác định đây là este của octadeca-9,12-dienoic acid. Phổ HMBC của hợp chất 5 cho ra tín hiệu của proton anome tại δH 4,80 (H-1′′) tương tác với carbon của nhóm glycerol (δC 70,6, C-1′) chỉ ra vị trí liên kết giữa tiểu phân đường với nhóm glycerol. Phối tử sulphoquinovos được đính tại vị trí C-6′′ được xác định qua độ chuyển dịch hoá học của C-6′′ (δC 54,3) cũng như tương tác HMBC giữa H-6′′ (δH 2,94 và 3,37) với C-5′′ (δC 69,8) và C-4′′ (δC 74,9). Vị trí este hóa của acid béo tại C-1 được xác định bởi tương tác HMBC giữa H-3′ (δH 4,12; 4,22) và carbonyl carbon C-1 (δC 175,6). Phân tích số liệu phổ của 5 và so sánh với tài liệu tham khảo cho phép xác định cấu trúc của hợp chất này là cibotiglycerol [9].
Hợp chất 6 thu được dưới dạng bột màu trắng. Công thức phân tử là C10H13N5O4, dựa trên phổ HR-ESI-MS tại m/z 268,1042 [M+H]+ (Tính toán lý thuyết cho công thức [C10H13N5O4]-, 268,1046). Trên phổ 1H-NMR của hợp chất 6 cho biết sự có mặt của hai proton thuộc dị vòng thơm tại δH 8,13 và 8,34, đặc trưng cho sự có mặt của adenin, một proton anome tại δH 5,87 (d, J = 6,5 Hz, H-1'), gợi ý sự có mặt của phần đường ribofuranosyl. Phổ 13C-NMR của hợp chất 6 xuất hiện 6 tín hiệu của tiểu phân adenin tại δC 152,0 (C-2), 149,1 (C-4), 119,9 (C-5), 156,0 (C-6), 139,9 (C-8) và các tín hiệu của đường ribofuranosyl tại δC 87,9 (C-1'), 73,4 (C-2'), 70,6 (C-3′), 85,8 (C-4′), 61,6 (C-5′). Số liệu phổ HR-MS và NMR của 6 hoàn toàn giống với số liệu phổ của adenosin [10] cho phép kết luận 6 chính là adenosin.
4. KẾT LUẬN
Từ sinh khối của vi tảo Aurantiochytrium sp. SC145 được thu thập tại đảo Sơn Ca, quần đảo Trường Sa, sáu hợp chất đã được phân lập, bao gồm một hợp chất dipeptid Cyclo-(L-Pro-L-Leu), một acid béo là (9Z,12Z)-Octadeca-9,12-dienoic acid, ba dẫn xuất este của acid béo gồm tyrosyl linoleat, (S)-2,3-dihydroxypropyl (9Z,12Z)-octadeca-9,12-dienoat, cibotiglycerol và một hợp chất alkaloid là adenosin. Kết quả nghiên cứu này góp phần làm sáng tỏ thành phần hoá học của loài vi tảo. Những nghiên cứu sâu hơn cần được tiến hành để đánh giá tác dụng sinh học của các hợp chất và cao chiết từ loài Aurantiochytrium sp. SC145.
Tài liệu tham khảo
2. Russo G. L., Langellotti A. L., Blasco T., Oliviero M., Sacchi R., Masi P., Production of omega-3 oil by Aurantiochytrium mangrovei using spent ssmotic solution from candied fruit industry as sole organic carbon source, 2021, 9(10):1834. DOI: 10.3390/pr9101834
3. Hien H. T. M., Thom L. T., Ha N. C., Tam L. T., Thu N. T. H., Nguyen T. V., Loan V. T., Dan N. T., Hong D. D., Characterization and optimization of culture conditions for Aurantiochytrium sp. SC145 Isolated from Sand Cay (Son Ca) Island, Vietnam, and antioxidative and neuroprotective activities of its polyunsaturated fatty acid mixture, 2022, 20(12):780. DOI: 10.3390/md20120780
4. Chen J., Jiao R., Jiang Y., Bi Y., Chen Z.-Y., Algal sterols are as effective as β-sitosterol in reducing plasma cholesterol concentration, Journal of Agricultural and Food Chemistry, 2014, 62(3):675-681. DOI: 10.1021/jf404955n
5. Pedras M. S. C., Yu Y., Liu J., Tandron-Moya Y. A., Metabolites produced by the phytopathogenic fungus Rhizoctonia solani: Isolation, chemical structure determination, syntheses and bioactivity, 2005, 60(9-10):717-722. DOI: 10.1515/znc-2005-9-1010
6. Iheanacho E. K., Igwe O. U., OnyemachI P. E. N., Isolation and characterization of linoleic acid from the leaves of Cnidoscolus aconitifolis (Miller) I. M. Johnston, Journal of Chemical Society of Nigeria, 2023, 48(2):245-256. DOI: 10.46602/jcsn.v48i2.870
7. Mateos R., Trujillo M., Pereira-Caro G., Madrona A., Cert A., Espartero J. L., New lipophilic tyrosyl esters. Comparative antioxidant evaluation with hydroxytyrosyl esters, Journal of Agricultural and Food Chemistry, 2008, 56(22):10960-10966. DOI: 10.1021/jf8020267
8. Kim C., Ha H., Kim J. S., Kim Y. T., Kwon S.-C., Park S. W., Induction of growth hormone by the roots of Astragalus membranaceus in pituitary cell culture, Archives of Pharmacal Research, 2003, 26(1):34-39. DOI: 10.1007/BF03179928
9. Cuong N. X., Minh C. V., Kiem P. V., Huong H. T., Ban N. K., Nhiem N. X., Tung N. H., Jung J.-W., Kim H.-J., Kim S.-Y., Kim J. A., Kim Y. H., Inhibitors of osteoclast formation from rhizomes of Cibotium barometz, Journal of Natural Products, 2009, 72(9):1673-1677. DOI: 10.1021/np9004097
10. Ciuffreda P., Casati S., Manzocchi A., Complete 1H and 13C NMR spectral assignment of α- and β-adenosine, 2′-deoxyadenosine and their acetate derivatives, Magnetic Resonance in Chemistry, 2007, 45(9):781-784. DOI: 10.1002/mrc.2036